
科目: 来源:2014届江苏省扬州市高二下学期期末调研测试化学试卷(解析版) 题型:实验题
碘溶于碘化钾溶液中形成I3—,并建立如下平衡:I3— I—+ I2。实验室可以通过氧化还原滴定法测定平衡时I3—的浓度
I—+ I2。实验室可以通过氧化还原滴定法测定平衡时I3—的浓度
实验原理:
为了测定平衡时的c(I3—) ,可用过量的碘与碘化钾溶液一起摇动,达平衡后取上层清液用标准的Na2S2O3滴定:2 Na2S2O3 + I2 = 2NaI + Na2S4O6。
由于溶液中存在I3— I— + I2的平衡,所以用硫代硫酸钠溶液滴定,最终测得的是I2和I3—的总浓度,设为c1,c1 =
c(I2)+c(I3—);c(I2)
的浓度可用相同温度下,测过量碘与水平衡时溶液中碘的浓度代替,设为c2,则c(I2)=
c2,c(I3—)=c1 —c2;
I— + I2的平衡,所以用硫代硫酸钠溶液滴定,最终测得的是I2和I3—的总浓度,设为c1,c1 =
c(I2)+c(I3—);c(I2)
的浓度可用相同温度下,测过量碘与水平衡时溶液中碘的浓度代替,设为c2,则c(I2)=
c2,c(I3—)=c1 —c2;
实验内容:
1.用一只干燥的100 mL 碘量瓶和一只250 mL碘量瓶,分别标上1、2号,用量筒取80 mL 0.0100 mol.L-1 KI于1号瓶,取200 mL 蒸馏水于2号瓶,并分别加入0.5 g过量的碘。
2.将两只碘量瓶塞好塞子,振荡30分钟,静置。
3.分别取上层清液20 mL用浓度为c mol/L标准Na2S2O3溶液进行滴定。1号瓶消耗V1 mL Na2S2O3溶液,2号瓶消耗V2 mL Na2S2O3溶液。
4.带入数据计算c(I3—)
试回答下列问题
(1)标准Na2S2O3溶液应装入 (填“酸式滴定管”或“碱式滴定管”),原因是 。
(2)碘量瓶在震荡静置时要塞紧塞子,可能的原因是
(3)滴定时向待测液中加入的指示剂是 ,到达滴定终点时的现象为 。
(4)用c 、V1 和V2 表示c(I3—)为 mol·L-1。
(5)若在测定1号瓶时,取上层清液时不小心吸入了少量的I2固体,则测定的c(I3—) (填“偏大”、“偏小”或“不变”)
查看答案和解析>>
科目: 来源:2014届江苏省扬州市高二下学期期末调研测试化学试卷(解析版) 题型:填空题
我国有丰富的天然气资源。以天然气为原料合成尿素的主要步骤如下图所示(图中某些转化步骤及生成物未列出):

(1)“造合成气”发生的热化学方程式是CH4(g)+H2O(g)  CO(g)+3H2(g);△H>0
CO(g)+3H2(g);△H>0
在恒温恒容的条件下,欲提高CH4的反应速率和转化率,下列措施可行的是 。
A、增大压强 B、升高温度 C、充入He气 D、增大水蒸气浓度
(2)“转化一氧化碳”发生的方程式是H2O(g) +CO(g)  H2(g)+CO2(g),该反应平衡常数随温度的变化如下:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下:
|
温度/℃ |
400 |
500 |
800 |
|
平衡常数K |
9.94 |
9 |
1 |
提高氢碳比[ n(H2O)/n(CO)],K值 (填“增大”、“不变”或“减小”);若该反应在400℃时进行,起始通入等物质的量的H2O和CO,反应进行到某一时刻时CO和CO2的浓度比为1∶3,此时v(正) v(逆)(填“>”、“=”或“<”)。
(3)有关合成氨工业的说法中正确的是 。
A、该反应属于人工固氮
B、合成氨工业中使用催化剂能提高反应物的利用率
C、合成氨反应温度控制在500℃左右,目的是使化学平衡向正反应方向移动
D、合成氨工业采用循环操作的主要原因是为了加快反应速率
(4)生产尿素过程中,理论上n(NH3)∶n(CO2)的最佳配比为 ,而实际生产过程中,往往使n(NH3)∶n(CO2)≥3,这是因为 。
(5)当甲烷合成氨气的转化率为60%时,以3.0×108 L甲烷为原料能够合成 L 氨气。(假设体积均在标准状况下测定)
查看答案和解析>>
科目: 来源:2014届江苏省扬州市高二下学期期末调研测试化学试卷(解析版) 题型:填空题
硝酸工业的基础是氨的催化氧化,在催化剂作用下发生如下反应:
① 4NH3(g)+5O2(g)  4NO(g)+6H2O(g)
△H = —905
kJ/mol ①主反应
4NO(g)+6H2O(g)
△H = —905
kJ/mol ①主反应
② 4NH3(g)+3O2(g)  2N2(g)+6H2O(g) △H = —1268 kJ/mol ②副反应
2N2(g)+6H2O(g) △H = —1268 kJ/mol ②副反应
有关物质产率与温度的关系如甲图。
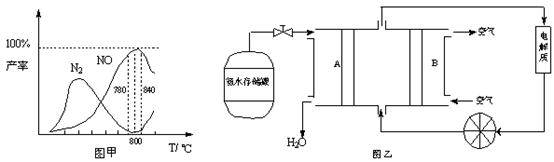
(1)由反应①②可知反应⑤N2(g) + O2(g)  2NO(g)的反应热ΔH=
2NO(g)的反应热ΔH=
(2)由图甲可知工业上氨催化氧化生成 NO时,反应温度最好控制在
(3)用Fe3O4制备Fe(NO3)3溶液时,需加过量的稀硝酸,原因一:将Fe4O3中的Fe2+全部转化为Fe3+,
原因二: (用文字和离子方程式说明)。
(4)将NH3通入NaClO溶液中,可生成N2H4,则反应的离子方程式为 。
(5)依据反应②可以设计成直接供氨式碱性燃料电池(如乙图所示),则图中A为 (填“正极”或“负极”),电极方程式为
查看答案和解析>>
科目: 来源:2014届江苏省扬州市高二下学期期末调研测试化学试卷(解析版) 题型:选择题
铜单质及其化合物在很多领域有重要的用途,如超细铜粉可应用于导电材料、催化剂等领域中。超细铜粉的某制备方法如下:

(1)[Cu(NH3)4]SO4中,N、O、S三种元素的第一电离能从大到小的顺序为: 。
(2) SO42-中硫原子的杂化轨道类型是 :写出一种与SO42-互为等电子体的分子 。
(3)某反应在超细铜粉做催化剂作用下生成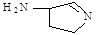 ,则分子中 σ 键与 π 键之比为
,则分子中 σ 键与 π 键之比为
(4)该化合物[Cu(NH3)4]SO4中存在的化学键类型有 。(填字母)
A.离子键 B.金属键 C.配位键 D.非极性键 E.极性键
(5)NH4CuSO3中的金属阳离子的核外电子排布式为 。
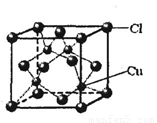
(6)铜的某氯化物的晶胞结构如右图所示,该化合物的化学式为 。
查看答案和解析>>
科目: 来源:2014届河南省平顶山市高二上学期期末考试化学试卷(解析版) 题型:选择题
下列物质的水溶液能导电,但属于非电解质的是
A.NH3 B.Cl2 C.C2H5OH D.CH3COOH
查看答案和解析>>
科目: 来源:2014届河南省平顶山市高二上学期期末考试化学试卷(解析版) 题型:选择题
下列变化过程,属于放热过程的是
A.液态水变成水蒸气 B.酸碱中和反应
C.弱酸电离 D.NH4Cl晶体与Ba(OH)2·8H2O混合搅拌
查看答案和解析>>
科目: 来源:2014届河南省平顶山市高二上学期期末考试化学试卷(解析版) 题型:选择题
下列燃烧反应的反应热不是燃烧热的是
①H2(g)+O2(g)=H2O(l) ΔH1 ②C(s)+O2(g)=CO(g) ΔH2
③S(s)+O2(g)=SO2(g) ΔH3 ④2H2S(g)+3O2(g)=2SO2(s)+2H2O(l) ΔH4
A.①③ B.②④ C.②③ D.①④
查看答案和解析>>
科目: 来源:2014届河南省平顶山市高二上学期期末考试化学试卷(解析版) 题型:选择题
下列关于燃烧热和中和热的比较中,错误的是
A.两者对应反应的△H均小于0
B.两者的单位均为kJ·mol-1,但mol-1的含义不同
C.两者的数值均不随反应物用量改变而改变
D.两者的数值均随反应物改变而改变
查看答案和解析>>
科目: 来源:2014届河南省平顶山市高二上学期期末考试化学试卷(解析版) 题型:选择题
合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为:
CO(g)+ H2O(g)  CO2(g) + H2(g)
△H <0
CO2(g) + H2(g)
△H <0
反应达到平衡后,为提高CO的转化率,下列措施中正确的是
A.增加压强 B.降低温度 C.增大CO 的浓度 D.更换催化剂
查看答案和解析>>
科目: 来源:2014届河南省平顶山市高二上学期期末考试化学试卷(解析版) 题型:选择题
下列各组离子在指定溶液中一定能大量共存的是
A.发生析氢腐蚀的溶液中:NH4+、Ba2+、AlO2-、Cl-
B.c(H+)/ c(OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl-
C.由水电离的c(H+)=1×10-14mol·L-1的溶液中:Ca2+、K+、Cl-、HCO3-
D.甲基橙呈红色的溶液中:Na+、CO32-、Fe3+、Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com