
科目: 来源:2014届江苏省启东市高二上学期期末考试化学试卷(解析版) 题型:填空题
蛇纹石可用于生产氢氧化镁,简要工艺流程如下:
I.制取粗硫酸镁:用酸液浸泡蛇纹石矿粉,过滤;并在常温常压下结晶,制得粗硫酸镁(其中常含有少量Fe3+、Al3+、Fe2+等杂质离子)。
II.提纯粗硫酸镁:将粗硫酸镁在酸性条件下溶解,加入适量的0.1 mol·L-H2O2溶液,再调节溶液pH至7~8,并分离提纯。
III.制取氢氧化镁:向步骤II所得溶液中加入过量氨水。
已知:金属离子氢氧化物沉淀所需pH
|
|
Fe3+ |
Al3+ |
Fe2+ |
Mg2+ |
|
开始沉淀时 |
1.5 |
3.3 |
6.5 |
9.4 |
|
沉淀完全时 |
3.7 |
5.2 |
9.7 |
12.4 |
请回答下列问题:
(1)步骤II中,可用于调节溶液pH至7~8的最佳试剂是 (填字母序号)。
A. MgO B. Na2CO3 C. 蒸馏水
(2)Fe2+与H2O2溶液反应的离子方程式为 。
(3)工业上常以Mg2+的转化率为考察指标,确定步骤III制备氢氧化镁工艺过程的适宜条件。其中,反应温度与Mg2+转化率的关系如右图所示。
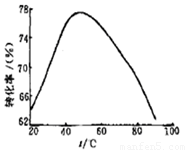
①步骤III中制备氢氧化镁反应的离子方程式为 。
②根据图中所示50 ℃前温度与Mg2+转化率之间 的关系,可判断此反应是
(填“吸热”或“放热”)反应。
③图中,温度升高至50 ℃以上Mg2+转化率下降的可能原因是 。
④ Ksp表示沉淀溶解平衡的平衡常数。已知:
Mg(OH)2(s)  Mg2+
(aq)+ 2OH- (aq) Ksp = c(Mg2+)·c2(OH-)
= 5.6×10-12
Mg2+
(aq)+ 2OH- (aq) Ksp = c(Mg2+)·c2(OH-)
= 5.6×10-12
Ca(OH)2(s)  Ca2+ (aq) + 2OH-
(aq) Ksp = c(Ca2+)·c2(OH-)
= 4.7×10-6
Ca2+ (aq) + 2OH-
(aq) Ksp = c(Ca2+)·c2(OH-)
= 4.7×10-6
若用石灰乳替代氨水, (填“能”或“不能”)制得氢氧化镁,理由是 。
查看答案和解析>>
科目: 来源:2014届江苏省启东市高二上学期期末考试化学试卷(解析版) 题型:计算题
(1) 常温下,已知0.1 mol·L-1一元酸HA溶液中c(OH-) / c(H+)=1×10-8。
①常温下,0.1 mol·L-1 HA溶液的pH= ;写出该酸(HA)与NaOH溶液反应的离子方程式: ;
②pH=3的HA与pH=11的NaOH溶液等体积混合后,溶液中4种离子物质的量浓度大小关系是: 。
(2) 常温下,向pH=a的氨水中加入等体积盐酸时,溶液呈中性,则此盐酸的pH 14-a(>、<、=)
(3) 向物质的量浓度均为0.01mol·L-1的MnCl2和BaCl2混合溶液中,滴加Na2CO3溶液,先沉淀的离子是 ,当两种难溶电解质共存时,溶液中c(Ba2+)/c(Mn2+) 。(此温度下,Ksp(BaCO3)=8.1×10-9、Ksp(MnCO3)=1.8×10-11)
(4)设Ka、Kh、Kw分别表示CH3COOH的电离平衡常数、CH3COO-的水解平衡常数和水的离子积常数,则三者之间的关系为:
查看答案和解析>>
科目: 来源:2014届江苏省启东市高二上学期期末考试化学试卷(解析版) 题型:填空题
(1)固定和利用CO2能有效地利用资源,并减少空气中的温室气体。工业上有一种用CO2来生产甲醇燃料的方法:CO2(g)+3H2(g)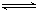 CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1。某科学实验将6molCO2和8molH2充入2L密闭容器中,测得H2的物质的量随时间变化如右图所示(实线)。图中数据a(1,6)代表的意思是:在l min时H2的物质的量是6mol。
CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1。某科学实验将6molCO2和8molH2充入2L密闭容器中,测得H2的物质的量随时间变化如右图所示(实线)。图中数据a(1,6)代表的意思是:在l min时H2的物质的量是6mol。
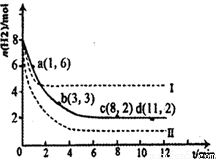
①下列时间段平均反应速率最大的是__________,最小的是______________。
A.0~1min B.1~3min C.3~8min D.8~11min
②仅改变某一实验条件再进行两次实验测得H2的物质的量随时间变化如图中虚线所示,曲线Ⅰ对应的实验改变的条件是________,曲线Ⅱ对应的实验改变的条件是_________。
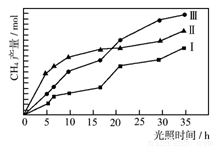
(2)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,等量的CO2和H2O(g)在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,CH4产量随光照时间的变化如图所示。在0~30 h内,CH4的平均生成速率v(Ⅰ)、v(Ⅱ)和v(Ⅲ)从大到小的顺序为 。反应开始后的12小时内,在第___________种催化剂的作用下,收集的CH4最多。
查看答案和解析>>
科目: 来源:2014届江苏省扬州市高二上学期期末考试化学试卷(解析版) 题型:选择题
下列除去碳酸钠固体中少量碳酸氢钠的方法正确的是
A.加入盐酸 B.加入氢氧化钙 C.加入氯化钡 D.加热
查看答案和解析>>
科目: 来源:2014届江苏省扬州市高二上学期期末考试化学试卷(解析版) 题型:选择题
当光束通过淀粉溶液时,从侧面观察到一条光亮的“通路”,说明淀粉溶液是
A.胶体 B.悬浊液 C.溶液 D.乳浊液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com