
科目: 来源:2014届江苏省启东市高二上学期期末考试化学试卷(解析版) 题型:选择题
合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为:
CO(g)+H2O(g)  CO2(g)+H2(g) ΔH<0
CO2(g)+H2(g) ΔH<0
反应达到平衡后,为提高CO的转化率,下列措施中正确的是( )
A.增加压强 B.降低温度 C.增大CO的浓度 D.更换催化剂
查看答案和解析>>
科目: 来源:2014届江苏省启东市高二上学期期末考试化学试卷(解析版) 题型:选择题
下列对于电化学说法正确的是 ( )
A.电解精练铜时,阳极泥中常含有金属金、银、锌等。
B.为保护浸入海水中的钢闸门,可在闸门表面镶上铜锭
C.充电电池放电时,化学能转变为电能
D.铅蓄电池放电时的负极和充电时的阴极均发生氧化反应
查看答案和解析>>
科目: 来源:2014届江苏省启东市高二上学期期末考试化学试卷(解析版) 题型:选择题
下列关于难溶电解质溶液说法正确的是 ( )
A.在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大
B.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol·L-1盐酸、③0.1 mol·L-1氯化镁溶液、④0.1 mol·L-1硝酸银溶液中,Ag+浓度:①>④=②>③
C.向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色:2AgCl+S2-=Ag2S↓+2Cl-
D.25 ℃时,在Mg(OH)2悬浊液中加入少量的NH4Cl固体后,c(Mg2+)增大
查看答案和解析>>
科目: 来源:2014届江苏省启东市高二上学期期末考试化学试卷(解析版) 题型:选择题
下列图示与对应的叙述相符的是 ( )
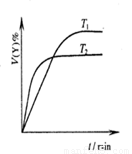
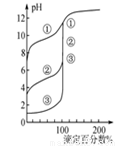
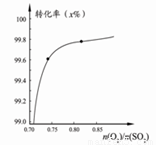
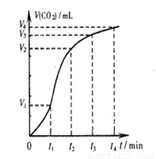
图1 图2 图3 图4
A.图1表示可逆反应“2X(g) Y(g)△H <0”,温度T1<T2的情形
Y(g)△H <0”,温度T1<T2的情形
B.用0.1000 mol·L-1NaOH溶液分别滴定浓度相同的三种一元酸,由图2曲线可确定①的酸性最强
C.在其它条件不变时,2SO2(g)
+O2(g)  2SO3(g)转化关系(如图3)中,纵坐标表示O2的转化率
2SO3(g)转化关系(如图3)中,纵坐标表示O2的转化率
D.图4表示碳酸钙与盐酸反应收集到气体最多的时间段是t3~t4
查看答案和解析>>
科目: 来源:2014届江苏省启东市高二上学期期末考试化学试卷(解析版) 题型:选择题
某蓄电池放电、充电时反应为:Fe+
Ni2O3 +3H2O  Fe(OH)2
+2Ni(OH)2下列推断不正确的是( )
Fe(OH)2
+2Ni(OH)2下列推断不正确的是( )
A.放电时,Fe为正极,Ni2O3为负极
B.充电时,阴极上的电极反应式是:Fe(OH)2 +2e-→Fe+2OH-
C.放电时,负极上的电极反应式是:Ni2O3 +3H2O+2e-→2Ni(HO)2 +2OH-
D.该蓄电池的电极必须是浸在某种碱性电解质溶液中
查看答案和解析>>
科目: 来源:2014届江苏省启东市高二上学期期末考试化学试卷(解析版) 题型:选择题
下列有关溶液中微粒的物质的量浓度关系正确的是 ( )
A.1L0.1mol·L-1(NH4)2Fe(SO4)2溶液: c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-)
B.25℃时,等体积、等浓度的NaX和弱酸HX混合后的溶液中:
c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-)
C.25℃时,BaCO3饱和溶液(Ksp =8.1×10-9): c(Ba2+)= c(CO32-)>c(H+) = c(OH-)
D.1.0 mol·L-1 Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3)
查看答案和解析>>
科目: 来源:2014届江苏省启东市高二上学期期末考试化学试卷(解析版) 题型:选择题
一定温度下,在4个容积均为1 L的恒容容器中分别进行反应(各容器中A都足量)
A(s)+B(g)  C(g)+D(g) ΔH =+100 kJ·mol-1,某时刻测得部分数据如下表:
C(g)+D(g) ΔH =+100 kJ·mol-1,某时刻测得部分数据如下表:
|
容器编号 |
n(B)/mol |
n(C)/mol |
n(D)/mol |
反应时间/min |
反应速率 |
|
Ⅰ |
0.06 |
0.60 |
0.10 |
t1 |
v(正)=v(逆) |
|
Ⅱ |
0.12 |
1.20 |
0.20 |
t2 |
|
|
Ⅲ |
0.32 |
1.0 |
0 |
0 |
|
|
Ⅳ |
0.12 |
0.30 |
|
|
v(正)=v(逆) |
下列说法正确的是 ( )
A.容器Ⅰ中平均反应速率v(B)=0.04/t1 mol·L-1·min-1
B.t2时容器Ⅱ中v(正)>v(逆)
C.容器Ⅲ中反应至平衡时吸热20 kJ
D.容器Ⅳ中c(D)= 0.4 mol·L-1
查看答案和解析>>
科目: 来源:2014届江苏省启东市高二上学期期末考试化学试卷(解析版) 题型:填空题
完成下列热化学方程式(化学方程式、电极反应式、表达式等)的书写:
(1)已知:2Cu(s)+1/2O2(g)=Cu2O(s);△H = -169kJ·mol-1,
C(s)+1/2O2(g)=CO(g);△H = -110.5kJ·mol-1,
Cu(s)+1/2O2(g)=CuO(s);△H = -157kJ·mol-1
用炭粉在高温条件下还原CuO生成Cu2O的热化学方程式是:
(2)在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g) 2SO3(g),写出该反应的化学平衡常数表达式:
2SO3(g),写出该反应的化学平衡常数表达式:
(3)以甲烷、空气为反应物,KOH溶液作电解质溶液构成燃料电池,则负极反应式为: 。
(4)无水AlCl3瓶盖打开有白雾,其反应的化学方程式为 。
(5)“镁—次氯酸盐”燃料电池,其装置示意图如图,该电池反应的总反应方程式为_____________________。
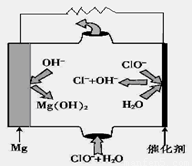
(6)工业上电解饱和食盐水的离子方程式为________________。
查看答案和解析>>
科目: 来源:2014届江苏省启东市高二上学期期末考试化学试卷(解析版) 题型:填空题
(1)在其他条件不变的情况下,研究改变起始氢气物质的量[用n(H2)表示]对N2(g)+3H2(g) 2NH3(g)反应的影响,实验结果可表示成如图所示的规律(图中T表示温度,n表示物质的量):
2NH3(g)反应的影响,实验结果可表示成如图所示的规律(图中T表示温度,n表示物质的量):
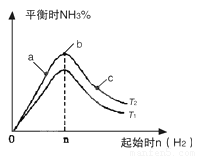
①比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是__________。
②若容器容积为1L,n=3mol,反应达到平衡时N2、H2的转化率均为60%,则在起始时体系中加入N2的物质的量为__________mol,此条件下(T2),反应的平衡常数K=_________,当温度升高时该平衡常数将__________。
③图像中T2和T1的关系是__________。(填“高于”、“低于”、“等于”、“无法确定”)。[ .Com]
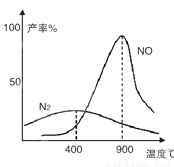
(2)氨气和氧气从145℃就开始反应,在不同温度和催化剂条件下生成不同产物(如图):
4NH3+5O2 4NO+6H2O
,4NH3+3O2
4NO+6H2O
,4NH3+3O2 2N2+6H2O
2N2+6H2O
温度较低时以生成__________为主,温度高于900℃时,NO产率下降的原因是___________________
查看答案和解析>>
科目: 来源:2014届江苏省启东市高二上学期期末考试化学试卷(解析版) 题型:填空题
高铁酸钾(K2FeO4)是铁的一种重要化合物,具有极强的氧化性。
(1)将适量K2FeO4溶解于pH=4.74的溶液中,配制成c(FeO42-)=1.0×10-3mol·L-的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)随时间变化的结果如图1所示。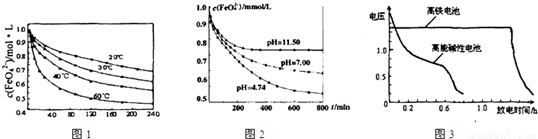
该实验的目的是_______________________;FeO42-发生反应的△H____________0(填“>”“<”或“=”)
(2)将适量K2FeO4分别溶解于pH=4.74、7.00、11.50的水溶液中,配制成c(FeO42-)=1.0×10-3 mol·L-的试样,静置,考察不同初始pH的水溶液对K2FeO4某种性质的影响,其变化图像见图2,800min时,在pH=11.50的溶液中,K2FeO4的浓度比在pH=4.74的溶液中高,主要原因是______________。
(3)电解法是工业上制备K2FeO4的一种方法。以铁为阳极电解氢氧化钠溶液,然后在阳极溶液中加入KOH,即在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),说明 。电解时阳极发生反应生成FeO42-,该电极反应式为______________。
(4)与MnO2—Zn电池类似,K2FeO4—Zn也可以组成高铁电池,K2FeO4在电池中作正极材料,其电极反应式为FeO42-+3eˉ+4H2O→Fe(OH)3+5OHˉ,则该电池总反应的离子方程式为_______________。图3为高铁酸钾电池和高能碱性电池放电曲线,由此可得出的高铁酸钾电池的优点有_______________________、________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com