
科目: 来源:2012-2013学年湖北省八市高三3月联考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.目前使用的燃料液化石油气,其主要成分均属于烃
B.食用白糖的主要成分是蔗糖,小苏打的主要成分是碳酸钠
C.明矾在自来水的生产过程中,常用于杀菌消毒
D.饮用酒在窖藏过程中主要发生酯化反应,酯化反应不属于取代反应
查看答案和解析>>
科目: 来源:2012-2013学年湖北省八市高三3月联考化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.24g NaH中阴离子所含电子总数为NA
B.标准状况下,22.4 L苯中含有C—H键数目为6NA
C.在碳酸钠溶液中,若c(CO32-)=1 mol•L-1,则c(Na+)=2 mol•L-1
D.通过MnO2催化使H2O2分解,产生32gO2时转移电子数为2NA
查看答案和解析>>
科目: 来源:2012-2013学年湖北省八市高三3月联考化学试卷(解析版) 题型:选择题
已知温度T时,水的离子积常数为KW,该温度下将V1mLa mol•L-1的一元酸HA与V2mLb mol•L-1的一元碱BOH充分混合,下列判断一定正确的是
A.若V1a=V2b,稀释此混合溶液时,溶液中各离子浓度一定都发生变化
B.若pH(HA)+ pH(BOH)=14,则V1=V2时,酸碱恰好完全中和
C.此混合液中:2c(H+)+c(B+)≤c(OH-)+c(A-)
D.若混合溶液中c(OH-)=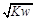 mol•L-1,则此溶液一定呈中性
mol•L-1,则此溶液一定呈中性
查看答案和解析>>
科目: 来源:2012-2013学年湖北省八市高三3月联考化学试卷(解析版) 题型:选择题
下表中所列的都是烷烃,它们的一卤取代物均只有一种,分析下表中各项的排布规律,按此规律排布第6项应为:
|
1 |
2 |
3 |
4 |
5 |
6 |
…… |
|
…… |
C2H6 |
C5H12 |
C8H18 |
…… |
|
…… |
A.C14H30 B.C17H36 C.C20H42 D.C26H54
查看答案和解析>>
科目: 来源:2012-2013学年湖北省八市高三3月联考化学试卷(解析版) 题型:选择题
下列有关离子方程式书写正确的
A.向含1molFeI2溶液中通入标准状况下22.4LCl2 2Fe2+ + 2I- + 2Cl2 = 2Fe3+ + I2 + 2Cl-
B.向醋酸钠溶液中通入过量CO2 CH3COO- + CO2 + H2O →HCO3- +2 CH3COOH
C.向NaHSO4溶液中滴加Ba(OH)2溶液至中性2H++ SO42- + Ba2+ + 2OH- = BaSO4↓ + 2H2O
D.以金属银为阳极电解饱和硫酸铜溶液 Cu2+ + 2H2O = 2Cu + O2↑+ 4H+
查看答案和解析>>
科目: 来源:2012-2013学年湖北省八市高三3月联考化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.将H2S通入FeCl3溶液中会产生淡黄色沉淀,继续通入则会产生黑色沉淀
B.在中和热测定的实验中,将NaOH溶液和盐酸混合反应后的最高温度作为末温度
C.分离Na2CO3溶液和CH3COOC2H5常用蒸馏法
D.能使湿润的KI淀粉试纸变蓝的气体一定是Cl2
查看答案和解析>>
科目: 来源:2012-2013学年湖北省八市高三3月联考化学试卷(解析版) 题型:选择题
某充电电池的原理如图所示,溶液中c(H+)=2.0 mol·L-1,阴离子为SO42-,a、b均为惰性电极,充电时右槽溶液颜色由绿色变为紫色。下列对此电池叙述正确的是
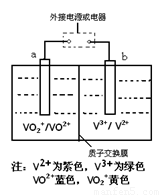
A.放电过程中,左槽溶液颜色由黄色变为蓝色
B.充电时,b极接直流电源正极,a极接直流电源负极
C.充电过程中,a极的反应式为:VO2++2H++e—= VO2+ +H2O
D.放电时,当转移1.0 mol电子时共有1.0 mol H+从左槽迁移进右槽
查看答案和解析>>
科目: 来源:2012-2013学年湖北省八市高三3月联考化学试卷(解析版) 题型:实验题
食盐中含有一定量的镁、铁等杂质,加碘盐中碘的损失主要是由于杂质、水分、空气中的氧气以及光照、受热而引起的。
已知:①氧化性: >Fe3+>I2;还原性:
>Fe3+>I2;还原性: >I-;②KI+I2
>I-;②KI+I2 KI3
KI3
(1)某学习小组对加碘盐进行如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得溶液分为4份。第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色。
①向第四份试液中加K3Fe(CN)6溶液,根据是否得到具有特征蓝色的沉淀,可检验是否含有 (用离子符号表示),蓝色的沉淀是_______(用化学式表示)。
②第二份试液中加入足量KI固体后,反应的离子方程式为:______、______
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失写出潮湿环境下KI与氧气反应的化学方程式:_________________。
将I2溶于KI溶液,在低温条件下,可制得KI3·H2O。该物质不适合作为食盐加碘剂,其理由是_________________________________。
(3)某同学为探究温度和反应物浓度对反应2IO3-+5SO32-+2H+=I2+5SO42-+H2O的速率的影响,设计实验如下表所示:
|
|
0.01mol·L-1KIO3 酸性溶液(含淀粉) 的体积/mL |
0.01mol·L-Na2SO3 溶液的体积/mL |
H2O的 体积/mL |
实验 温度 /℃ |
溶液出现 蓝色时所 需时间/s |
|
实验1 |
5 |
V1 |
35 |
25 |
t1 |
|
实验2 |
5 |
5 |
40 |
25 |
t2 |
|
实验3 |
5 |
5 |
V2 |
0 |
t3 |
表中数据:t1 t2(填“>”、“<”或“=”);表中V2=___________mL
查看答案和解析>>
科目: 来源:2012-2013学年湖北省八市高三3月联考化学试卷(解析版) 题型:填空题
“低碳循环”已引起各国家的高度重视,而如何降低大气中CO2的含量和有效地开发利用CO2正成为化学家研究的主要课题。
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
___ C+ ___ KMnO4+ ____ H2SO4→____CO2↑+ ____MnSO4 + ____K2SO4+ ____H2O
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
|
实验组 |
温度℃ |
起始量/mol |
平衡量/mol |
达到平衡所需 时间/min |
||
|
CO |
H2O |
H2 |
CO |
|||
|
1 |
650 |
4 |
2 |
1.6 |
2.4 |
6 |
|
2 |
900 |
2 |
1 |
0.4 |
1.6 |
3 |
|
3 |
900 |
a |
b |
c |
d |
t |
①实验2条件下平衡常数K= 。
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b 的值______(填具体值或取值范围)。
③实验4,若900℃时,在此容器中加入CO、H2O、CO2 、H2均为1mol,则此时V正 V逆(填“<” ,“>” ,“=”)。
(3)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH=-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH=-566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:____________
(4)已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性。常温下,向10 mL 0.01 mol·L-1 H2C2O4溶液中滴加10mL 0.01mol·L-1 NaOH溶液时,比较溶液中各种离子浓度的大小关系 ;
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。
CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为1×10-4mo1/L ,则生成沉淀所需CaCl2溶液的最小浓度为 mo1/L 。
查看答案和解析>>
科目: 来源:2012-2013学年湖北省八市高三3月联考化学试卷(解析版) 题型:实验题
铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与H2SO4反应)。某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究。

A B C
Ⅰ.铁矿石中含氧量的测定
① 按上图组装仪器,检查装置的气密性;
② 将5.0g铁矿石放入硬质玻璃管中,装置B、C中的药品如图所示(夹持仪器均省略);
③ 从左端导气管口处不断地缓缓通入H2,待C装置出口处H2验纯后,点燃A处酒精灯
④ 充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却。
(1)装置C的作用为 。
(2)测的反应后装置B增重1.35g,则铁矿石中氧的百分含量为 。
Ⅱ.铁矿石中含铁量的测定
(1)步骤④中煮沸的作用是 。
(2)步骤⑤中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、 。
(3)下列有关步骤⑥的操作中说法正确的是 。

a.因为碘水为黄色,所以滴定过程中不需加指示剂
b.滴定过程中可利用淀粉溶液作为指示剂
c.滴定管用蒸馏水洗涤后可以直接装液
d.锥形瓶不需要用待测液润洗
e.滴定过程中,眼睛注视滴定管中液面变化
f.滴定结束后,30s内溶液不恢复原来的颜色再读数
(4)若滴定过程中消耗0.5000mol·L−1KI溶液20.00mL,则铁矿石中铁的百分含量为 。
Ⅲ.由Ⅰ、Ⅱ可以推算出该铁矿石中铁的氧化物的化学式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com