
科目: 来源:2012-2013学年浙江省高三第一次统练化学试卷(解析版) 题型:选择题
图表法、图象法是常用的科学研究方法。
(1)短周期某主族元素M的电离能情况如图A所示。则M元素位于周期表的第 族。
(2)图B是研究部分元素的氢化物的沸点变化规律的图像,折线c可以表达出第 族元素氢化物的沸点的变化规律。不同同学对某主族元素氢化物的沸点的变化趋势画出了两条折线——折线a和折线b,你认为正确的是: (填“a”或“b”)。

查看答案和解析>>
科目: 来源:2012-2013学年浙江省高三第一次统练化学试卷(解析版) 题型:选择题
原子序数小于36的A、B、C、D四种元素,A原子基态时最外层电子数是其内层电子数的2倍,B原子基态时2p原子轨道上有3个未成对的电子,C的基态原子中有4个未成对电子,D的原子序数比C大3。
回答下列问题:
(1)B的氢化物沸点比A的氢化物沸点高,其主要原因是 。(2)元素A的一种氧化物与元素B的一种氧化物互为等电子体(原子个数和电子个数均相等的为等电子体),元素B的这种氧化物的分子式是 。
(3)C3+核外电子排布式是
查看答案和解析>>
科目: 来源:2012-2013学年浙江省高三第一次统练化学试卷(解析版) 题型:填空题
A、B、C都是元素周期表中的短周期非金属元素,它们的核电荷数依次增大。A原子的核外成对电子数与未成对电子数相等,B原子的最外层p轨道的电子为半满结构,C是地壳中含量最多的元素。D、E是第四周期元素,D原子核外最外层电子数有1个电子,其余各层电子均充满;E原子核外未成对电子数在同周期中最多。请用对应的元素符号或化学式填空:
⑴A、B、C的第一电离能由小到大的顺序为 。
⑵D与E的原子化热分别为340 kJ·mol-1和125 kJ·mol-1,则它们的熔点:D E(填“>”、“<”、“=” )。
⑶分子A2B2中键与键之间的夹角为180°,并有对称性,每个原子最外层电子数均满足八电子,其结构式为_____________,1mol该分子中含有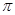 键的数目为 。
键的数目为 。
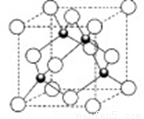
⑷基态E原子的外围电子排布式为 。EO2Cl2熔点:-96 .5℃,沸点:117℃,则固态EO2Cl2属于 晶体。
⑸D的氢化物的晶体结构如图所示,其化学式是 ,图中白球构成的晶体结构是由 (填“密置层”或“非置密层”)按一定的方式在三维空间堆积形成的,写出此氢化物在氯气中燃烧的化学方程式 。
查看答案和解析>>
科目: 来源:2012-2013学年浙江省高三第一次统练化学试卷(解析版) 题型:填空题
决定物质性质的重要因素是物质的结构。请回答下列问题:
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
|
电离能/kJ·mol-1 |
I1 |
I2 |
I3 |
I4 |
|
A |
578 |
1817 |
2745 |
11578 |
|
B |
738 |
1451 |
7733 |
10540 |
A通常显 价,A的电负性 B的电负性(填“>”、“<”或“=”)。
(2)已知:波长为300 nm的紫外光的光子,光子的能量与光的频率的关系为E=hv,式中h=6.63×10-34J·s,光的波长 与光的频率v的关系为
与光的频率v的关系为 ,其中光速c=3×108m·s-1。根据下表有关蛋白质分子中重要化学键的信息,求波长为300 nm的紫外光的光子所具有的能量
kJ·mol-1,说明人体长时间照射紫外光后皮肤是否会受伤害的原因: 。(未说明原因不给分)
,其中光速c=3×108m·s-1。根据下表有关蛋白质分子中重要化学键的信息,求波长为300 nm的紫外光的光子所具有的能量
kJ·mol-1,说明人体长时间照射紫外光后皮肤是否会受伤害的原因: 。(未说明原因不给分)
|
共价键 |
C—C |
C—N |
C—S |
|
键能/kJ·mol-1 |
347 |
305 |
259 |
(3)科学家通过X射线探明,KCl、MgO、CaO、TiN的晶体结构与NaCl的晶体结构相似。下表是3种离子晶体的晶格能数据:
|
离子晶体 |
NaCl |
KCl |
CaO |
|
晶格能/kJ·mol-1 |
786 |
715 |
3401 |
离子键的强弱可以用离子晶体的晶格能来衡量,KCl、CaO、TiN 3种离子晶体熔点从高到低的顺序是 。MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有 个。
(4)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是 。
(5)某配合物的分子结构如图所示,其分子内不含有 (填字母)。

A.离子键 B.共价键 C.配位键 D.氢键
查看答案和解析>>
科目: 来源:2012-2013学年浙江省高三第一次统练化学试卷(解析版) 题型:填空题
水是人类生存和发展的宝贵资源,而水质的污染问题却越来越严重。目前,世界各国已高度重视这个问题,并采取积极措施进行治理。
(1)下列项目:色度、浊度、pH、某些金属离子、氯离子、硫酸根离子、氮和磷的化合物、 、生化需氧量等都是评价水质需要检测的项目,其中生化需氧量主要是检测水体中 (填“哪类物质”)消耗氧气的量。
(2)工业废水中常含有不同类型的污染物,可采用不同的方法处理。以下处理措施和方法都正确的是________(填字母编号,可多选)。
|
选项 |
污染物 |
处理措施 |
方法类别 |
|
A |
废酸 |
加生石灰中和 |
物理法 |
|
B |
Cu2+等重金属离子 |
加硫酸盐沉降 |
化学法 |
|
C |
含纯碱的废水 |
加石灰水反应 |
化学法 |
(3)下图是某市污水处理的工艺流程示意图:

① 下列物质中不可以作为混凝剂(沉降剂)使用的是 (填字母编号,可多选)。
A.偏铝酸钠 B.氧化铝 C.碱式氯化铝 D.氯化铁
② 混凝剂除去悬浮物质的过程是 (填字母编号)。
A.只是物理过程 B. 只是化学过程 C. 是物理和化学过程
(4)在氯氧化法处理含CN一的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
某厂废水中含KCN,其浓度为650 mg·L-1。现用氯氧化法处理,发生如下反应:
KCN + 2KOH + Cl2 = KOCN + 2KCl + H2O 再投入过量液氯,可将氰酸盐进一步氯化为氮气。请配平下列化学方程式:口KOCN + 口KOH + 口Cl2→ 口CO2 + 口N2 + 口KCl + 口H2O若处理上述废水20L,使KCN完全转化为无毒物质,至少需液氯 g。
查看答案和解析>>
科目: 来源:2012-2013学年浙江省高三第一次统练化学试卷(解析版) 题型:填空题
地球的海水总量约有1.4×1018t,是人类最大的资源库。
(1)如图利用海水得到淡水的方法为 。

(2)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如下图。a是电源的 极;Ⅰ口排出的是 (填“淡水” 或“浓水”)。

(3)海水淡化后的浓水中含大量盐分(主要含有Mg2+、Ca2+、Fe3+和SO42-),排入水中会改变水质,排到土壤中会导致土壤盐碱化,故不能直接排放,可以与氯碱工业联产。
电解前需要把浓水精制,所需试剂主要包括:HCl、NaOH、BaCl2、Na2CO3等),其中HCl的作用主要是 。
(4)铀是核反应最重要的燃料,其提炼技术直接关系着一个国家核工业或核武器的发展水平,海水中铀以UCl4形式存在(以离子形式存在),每吨海水只含3.3毫克铀,海水总量极大,铀总量相当巨大。不少国家正在探索海水提铀的方法。现在,已经研制成功一种螯合型离子交换树脂,它专门吸附海水中的铀,而不吸附其他元素。其反应原理为:___________________________(树脂用HR代替),发生离子交换后的离子交换膜用酸处理还可再生并得到含铀的溶液,其反应原理为:________________________。
(5)离子交换树脂法是制备纯水(去离子水) 的主要方法。某阳离子交换树酯的局部结构可写成(如图)。该阳离子交换树脂是由单体苯乙烯和交联剂对二乙烯基苯聚合后再经 反应得到的。自来水与该离子交换树脂交换作用后显 (填“酸性”、“碱性”或“中性”)。

(6)中国《生活用水卫生标准》中规定,水的总硬度不能过大。如果硬度过大,饮用后对人体健康与日常生活有一定影响。暂时硬水的硬度是由 (填阴离子符号)引起的,经 (填操作名称)后可被去掉。永久硬水的硬度可由离子交换法去掉。
查看答案和解析>>
科目: 来源:2012-2013学年浙江省高三第一次统练化学试卷(解析版) 题型:填空题
某金属(A)在TK以下晶体的基本结构单元如左下图所示,T K以上转变为右下图所示结构的基本结构单元,在两种晶体中最邻近的A原子间距离相同
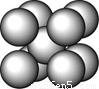

(1)在T K以下的纯A晶体中,与A原子等距离且最近的A原子数为______个;在T K以上的纯A晶体中,与A原子等距离且最近的A原子数为___________;
(2)纯A晶体在晶型转变前后,二者基本结构单元的边长之比为(TK以上与TK以下之比)___________。
(3)左上图的的堆积方式为 , 经测定其结构和性质参数如下表所示
|
金属 |
相对原子质量 |
分区 |
密度/g·㎝-3 |
原子化热/kJ·mol-1 |
|
Na |
22.99 |
s区 |
0.960 |
108.4 |
|
A |
60.20 |
d区 |
7.407 |
7735 |
则A原子的原子半径为 pm,试解释该晶体原子化热很高的原因 。
(已知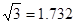 ,7.407≈
,7.407≈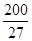 ,1pm=10
,1pm=10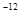 m)
m)
查看答案和解析>>
科目: 来源:2012-2013学年湖北省七市(州)高三4月联考模拟试卷理综化学试卷(解析版) 题型:选择题
化学与环境保护密切相关,下列叙述正确的是
A.绿色化学的核心是应用化学原理治理环境污染
B.处理废水时加人明矶作为消毒剂可以除去水中的杂质
C.某雨水样品采集后放置一段时间,pH由4.68变为4.28,是因为水中溶解了较多的CO2
D.PM2.5 (2.5微米以下的细颗粒物)主要来自化石燃料的燃烧
查看答案和解析>>
科目: 来源:2012-2013学年湖北省七市(州)高三4月联考模拟试卷理综化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,224mL水含有的电子数为0.1NA
B.1L 0.1mol/L硅酸钠溶液中含有0.1NA个SiO32-
C.足量的铁粉与lmolCl2在加热条件下充分反应,转移的电子数为3NA
D.标准状况下,11.2LCO2和SO2混合气体中含NA个氧原子
查看答案和解析>>
科目: 来源:2012-2013学年湖北省七市(州)高三4月联考模拟试卷理综化学试卷(解析版) 题型:选择题
下列有关溶液中离子浓度的关系,不正确的是
A.NaHCO3溶液中存在:c(OH-)=c(H2CO3)+c(H+)
B.常温下,pH=3的盐酸和pH=ll的氨水等体积混合后,溶液中:c(NH4+)>c(Cl-)
C.0.2 mol/LNH4Cl溶液与0.1 mol/L NaOH溶液等体积混合后,溶液中:c(NH4+)>c(Na+)
D.0.2 mol/L 的 CH3COOH 溶液中 c(H+)小于0.1 mol/L 的 CH3COOH 中c(H+)的两倍
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com