
科目: 来源:2012-2013学年江苏省苏北三市高三第二次调研测试化学试卷(解析版) 题型:选择题
下列有关说法正确的是
A.合成氨反应需使用催化剂,说明催化剂可以促进该平衡向生成氨的方向移动
B.铅蓄电池在放电过程中,负极质量增加,正极质量减少
C.100 mL pH=3的HA和HB分别与足量的锌反应,HA放出的氢气多,说明HA酸性比HB弱
D.已知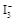
 I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大
I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大
查看答案和解析>>
科目: 来源:2012-2013学年江苏省苏北三市高三第二次调研测试化学试卷(解析版) 题型:选择题
增塑剂DCHP可由邻苯二甲酸酐与环己醇反应制得。
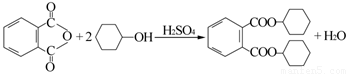
邻苯二甲酸酐 DCHP
下列说法正确的是
A.邻苯二甲酸酐的二氯代物有3种
B.环己醇分子中所有的原子可能共平面
C.DCHP能发生加成、取代、消去反应
D.1 mol DCHP最多可与含2 mol NaOH的溶液反应
查看答案和解析>>
科目: 来源:2012-2013学年江苏省苏北三市高三第二次调研测试化学试卷(解析版) 题型:选择题
Q、W、X、Y、Z是原子序数依次增大的短周期元素,X的焰色反应呈黄色。Q元素
的原子最外层电子数是其内层电子数的2倍。W、Z最外层电子数相同,Z的核电荷数是W的2倍。元素Y的合金是日常生活中常用的金属材料。下列说法正确的是
A.原子半径的大小顺序:rX> rY> rW> rQ
B.元素Q和Z能形成QZ2型的共价化合物
C.工业上常用电解的方法制备X、Y的单质
D.X、Y的最高价氧化物的水化物之间不能反应
查看答案和解析>>
科目: 来源:2012-2013学年江苏省苏北三市高三第二次调研测试化学试卷(解析版) 题型:选择题
下列根据实验操作和现象所得出的结论不正确的是
选项 实验操作 实验现象 结 论
A 测定等浓度的Na2CO3和Na2SO3 溶液的pH 前者pH比后者的大 非金属性:S>C
B SO2通入酸性高锰酸钾溶液 高锰酸钾溶液褪色 SO2具有漂白性
C 溴乙烷与NaOH溶液共热后,加HNO3酸化的AgNO3溶液 出现淡黄色沉淀 溴乙烷发生了水解
D 向等浓度的KBr、KI混合液中滴加AgNO3溶液 先出现黄色沉淀 Ksp(AgBr)> Ksp(AgI)
查看答案和解析>>
科目: 来源:2012-2013学年江苏省苏北三市高三第二次调研测试化学试卷(解析版) 题型:选择题
在一密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:
Ni(s)+4CO(g)  Ni(CO)4(g),已知该反应在25℃和80℃时的平衡常数分别为
Ni(CO)4(g),已知该反应在25℃和80℃时的平衡常数分别为
5×104和2,下列说法正确的是
A.上述生成Ni(CO)4(g)的反应为吸热反应
B.在80℃时,测得某时刻,Ni(CO)4 、CO浓度均为0.5 mol·L-1,则此时v(正)<v(逆)
C.恒温恒压下,向容器中再充入少量的Ar,上述平衡将正向移动
D.恒温恒容下,向容器中再充入少量Ni(CO)4(g),达新平衡时,CO 的百分含量将增大
查看答案和解析>>
科目: 来源:2012-2013学年江苏省苏北三市高三第二次调研测试化学试卷(解析版) 题型:选择题
已知在相同条件下酸性强弱顺序为:CH3COOH>H2CO3>HCN>HCO3—。下列表述不正确的是
A.25℃时,等物质的量浓度的各溶液pH关系为:pH(Na2CO3)>pH(NaCN)>pH(NaHCO3)>pH(CH3COONa)
B.a mol·L-1 HCN溶液与b mol·L-1 NaOH溶液等体积混合后,所得溶液中:c(Na+)=c(CN-),则a一定大于b
C.0.1 mol·L-1的Na2CO3溶液中:c(OH-)=c(H+)+c(HCO3-)+c(H2CO3)
D.25℃时,pH=4.75,浓度均为0.1 mol·L-1的CH3COOH、CH3COONa混合溶液:c(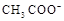 )+c(
)+c(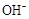 )<c(CH3COOH)+c(H+)
)<c(CH3COOH)+c(H+)
查看答案和解析>>
科目: 来源:2012-2013学年江苏省苏北三市高三第二次调研测试化学试卷(解析版) 题型:填空题
硫酸锌是制备荧光粉的原料之一。工业上由锌白矿(主要成分是ZnO,还含有Fe2O3、CuO、SiO2等杂质)制备ZnSO4•7H2O的流程如下。
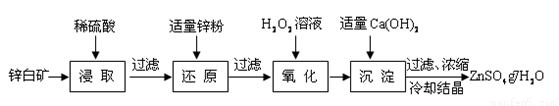
已知:常温下,溶液中的Fe3+、Zn2+、Fe2+以氢氧化物形式完全沉淀的pH分别为:3.7,6.5,9.7。
(1)浸取过程中提高浸出效率可采用的措施有 (任答一条),
ZnO和硫酸反应的化学方程式为 。
(2)加入适量锌粉的作用为:①使溶液中的Fe3+转化为Fe2+;② 。
(3)氧化过程中H2O2发生反应的离子方程式为 。
(4)加入适量Ca(OH)2调节溶液pH,促进Fe3+水解,Fe3+水解反应的平衡常数表达式
K= ,Ca(OH)2不能过量的原因是 。
查看答案和解析>>
科目: 来源:2012-2013学年江苏省苏北三市高三第二次调研测试化学试卷(解析版) 题型:填空题
已知: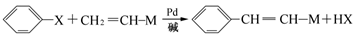 (X为卤原子,M为烃基或含酯基的取代基等)
(X为卤原子,M为烃基或含酯基的取代基等)
由有机物A合成G(香豆素)的步骤如下:
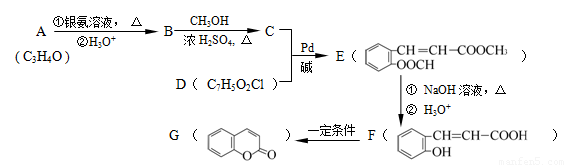
回答下列问题:
(1)写出C中含氧官能团名称: ,F→G 的反应类型是 。
(2)写出A和银氨溶液反应的化学方程式 。
(3)D的结构简式为 。
(4)F有多种同分异构体,写出同时满足下列条件的一种同分异构体的结构简式: 。
Ⅰ. 分子中除苯环外,无其它环状结构; Ⅱ.苯环上有两个处于对位的取代基;
Ⅲ. 能发生水解反应,不能与Na反应; Ⅳ.能与新制Cu(OH)2按物质的量比1:2反应
(5)二氢香豆素(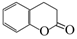 )常用作香豆素的替代品,鉴别二氢香豆素和它的一种同分异构体(
)常用作香豆素的替代品,鉴别二氢香豆素和它的一种同分异构体(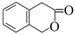 )需要用到的试剂有:NaOH溶液、 。
)需要用到的试剂有:NaOH溶液、 。
(6)已知: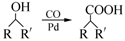 (R,R′为烃基),试写出以苯和丙烯(
(R,R′为烃基),试写出以苯和丙烯(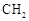 =CH—CH3)
=CH—CH3)
为原料,合成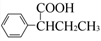 的路线流程图(无机试剂任选)。合成路线流程图示例如下:
的路线流程图(无机试剂任选)。合成路线流程图示例如下:
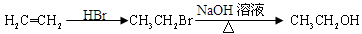
查看答案和解析>>
科目: 来源:2012-2013学年江苏省苏北三市高三第二次调研测试化学试卷(解析版) 题型:计算题
以黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备二氧化氯气体,再用水吸收获得二氧化氯溶液。在此过程中需要控制适宜的温度,若温度不当,副反应增加,影响生成ClO2气体的纯度,且会影响ClO2气体的吸收率。具体情况如图6所示。请回答下列问题
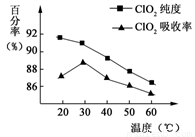
(1)据图可知,反应时需要控制的适宜温度是 ℃,达到此要求采取的适宜措施是 。
(2)已知:黄铁矿中的硫元素在酸性条件下被ClO3-氧化成SO42-,写出制备二氧化氯的离子方程式: 。
(3)某校化学学习小组拟以“m(ClO2)/m(NaClO3)”作为衡量ClO2产率的指标。若取NaClO3样品质量6.0g,通过反应和吸收可得400
mL ClO2溶液,取出20 mL,加入37.00 mL
0.500 mol· (NH4)2Fe(SO4)2
溶液充分反应,过量Fe2+再用0.0500 mol·
(NH4)2Fe(SO4)2
溶液充分反应,过量Fe2+再用0.0500 mol· K2Cr2O7标准溶液滴定至终点,消耗20.00 mL。反应原理如下:
K2Cr2O7标准溶液滴定至终点,消耗20.00 mL。反应原理如下:
4H++ClO2+5Fe2+=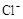 +5Fe3+
+2H2O
+5Fe3+
+2H2O
14H+ +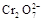 +6
Fe2+ =2Cr3+ + 6 Fe3+ +7H2O
+6
Fe2+ =2Cr3+ + 6 Fe3+ +7H2O
试计算ClO2的“产率”。(写出计算过程)
查看答案和解析>>
科目: 来源:2012-2013学年江苏省苏北三市高三第二次调研测试化学试卷(解析版) 题型:实验题
盐泥是氯碱工业中的废渣,主要含有镁、铁、铝、钙等的硅酸盐和碳酸盐。实验室以盐泥为原料制取MgSO4·7H2O的流程如下:

已知:(Ⅰ) Ksp[Mg(OH)2]=6.0×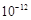
(Ⅱ) Fe2+、Fe3+、Al3+开始沉淀到完全沉淀的pH范围依次为:7.1~9.6、2.0~3.7、3.1~4.7
(Ⅲ) 三种化合物的溶解度(S)随温度变化曲线如图。
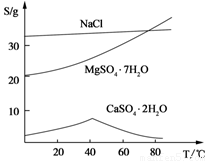
回答下列问题:
(1)在盐泥中加H2SO4溶液控制pH为1~2以及第一次煮沸的目的是: 。
(2)若溶液中Mg2+的浓度为6 mol/L,溶液pH≥ 才可能产生Mg(OH)2沉淀。
(3)第二次过滤需要趁热进行,主要原因是 。所得滤渣的主要成分是 。
(4)从滤液Ⅱ中获得MgSO4·7H2O晶体的实验操作步骤为:①向滤液Ⅱ中加入 ,②过滤,得沉淀,③ ,④蒸发浓缩,降温结晶,⑤过滤、洗涤得产品。
(5)若获得的MgSO4·7H2O质量为24.6 g,则该盐泥中含镁[以Mg(OH)2计]的百分含量约 (MgSO4·7H2O式量为246)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com