
科目: 来源:2012-2013学年江苏省泰州市高三上学期期末考试化学试卷(解析版) 题型:选择题
甲、乙、丙、丁为4种短周期元素,在周期表中,甲与乙、丙、丁在周期表中的位置关系如图所示(原子序数:乙>丙)。丁的原子序数与乙、丙原子序数之和相等,4种元素原子的最外层电子数之和为24。下列判断正确的是
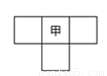
A.元素甲的简单气态氢化物稳定性比乙的强
B.元素丁在周期表中的位置为第3周期,VIA族
C.元素丙和元素丁的最高价氧化物对应的水化物均为强酸
D.4种元素的简单阴离子半径从大到小顺序为:丁>乙>丙>甲
查看答案和解析>>
科目: 来源:2012-2013学年江苏省泰州市高三上学期期末考试化学试卷(解析版) 题型:选择题
硝苯地平是第一代钙拮抗剂,为抗高血压、防治心绞痛药物,结构如图所示。下列说法中错误的是
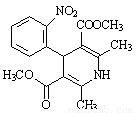
A.该物质的分子式为C17H18N2O6
B.该物质能使酸性KMnO4溶液褪色
C.1 mol该物质最多能与6 molH2发生加成反应
D.一定条件下,该物质既能与盐酸反应、又能与NaOH溶液反应
查看答案和解析>>
科目: 来源:2012-2013学年江苏省泰州市高三上学期期末考试化学试卷(解析版) 题型:选择题
下列根据实验操作和现象所得出的结论正确的是
选项 实验操作 实验现象 结论
A 淀粉溶液中加稀硫酸,加热片刻,滴加银氨溶液,再水浴加热 无银镜生成 淀粉未发生水解
B 向溶液X中加入稀盐酸,并将产生的无色气体通入澄清石灰水中 生成白色沉淀 溶液X中一定含有CO32-或HCO3-
C 将一片铝箔置于酒精灯外焰上灼烧 铝箔熔化但不滴落 铝箔表面有致密Al2O3薄膜,且Al2O3熔点高于Al
D 取久置的绿矾(FeSO4·7H2O)溶于水,加入KSCN溶液 溶液变为血红色 绿矾部分或全部被氧化
查看答案和解析>>
科目: 来源:2012-2013学年江苏省泰州市高三上学期期末考试化学试卷(解析版) 题型:选择题
某碱性溶液中只含有Na+、CH3COO-、H+、OH- 4种离子。下列描述正确的是
A.该溶液可能由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成
B.该溶液由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成
C.该溶液中离子浓度一定为c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.加入一定量冰醋酸,c(CH3COO-)可能大于、等于或小于c(Na+)
查看答案和解析>>
科目: 来源:2012-2013学年江苏省泰州市高三上学期期末考试化学试卷(解析版) 题型:选择题
T1℃时,向容积为2L的密闭容器中充入一定量的A气体和B气体,发生如下反应:
A(g)+2B (g)  C(g)
C(g)
反应过程中测定的部分数据见下表:
|
反应时间/min |
n(A)/mol |
n(B)/ mol |
|
0 |
1.00 |
1.20 |
|
10 |
0.50 |
|
|
30 |
|
0.20 |
下列说法正确的是
A.前10 min内反应的平均速率为v(C)=0.050 mol·L-1·min-1
B.保持其他条件不变,起始时向容器中充入0.50 mol A气体和0.60 mol B气体,到达平衡时,n(C)<0.25 mol
C.若密闭容器体积可变,其他条件不变,在达到平衡后持续缩小容器体积,则平衡一直会正向移动
D.温度为T2℃时(T1>T2),上述反应平衡常数为20,则正反应为放热反应
查看答案和解析>>
科目: 来源:2012-2013学年江苏省泰州市高三上学期期末考试化学试卷(解析版) 题型:填空题
垃圾焚烧发电产生的烟气中含烟尘、二氧化硫、氮氧化物、氯化氢等有害物质,处理流程如下:

(1)麻石洗涤塔中设置多层格栅,上面放置大量耐酸碱塑料小球,塔内设置多层上喷下淋水嘴,“烟气”从塔底进入,目的是 。
(2)若NO2和NO气体以物质的量之比1:1混合通入石灰水中,发生氧化还原反应生成一种正盐和水,请写出反应的化学方程式 ;已知此正盐的水溶液呈碱性,用离子方程式表示 。
(3)废液在沉淀池中慢慢沉降,沉淀主要含 ;在回收再生池中加入NaOH固体的作用是 。
(4)环境检测部门测量处理前后烟气中烟尘的含量见下表:
|
项目 |
监测结果 |
国标号 |
|
|
处理前 |
处理后 |
GWKB3—2000 |
|
|
烟尘(mg/m3) |
13929.0 |
61.0 |
80 |
其获得监测结果中的数据使用的测定方法为 。
查看答案和解析>>
科目: 来源:2012-2013学年江苏省泰州市高三上学期期末考试化学试卷(解析版) 题型:填空题
盐酸氟西汀(商品名叫“百忧解”)是一种口服抗抑郁药,用于治疗抑郁症、强迫症及暴食症,其合成路线如下:
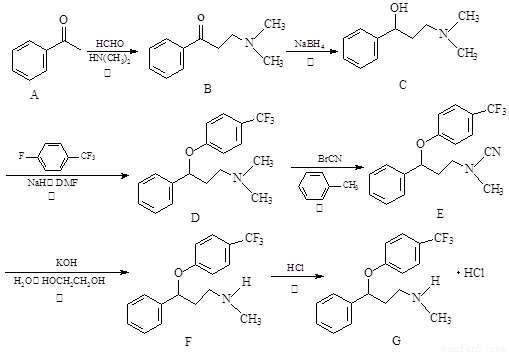
(1)反应②~⑥中属于还原反应的是 (填序号)。
(2)化合物F中含 个手性碳原子;化合物F和G中水溶性较强的是 。
(3)分析A的同分异构体中,有一种能发生银镜反应且核磁共振氢谱图有4种峰的有机 物,写出它和银氨溶液发生银镜反应的离子方程式 。
(4)反应①可视为两步完成,第1步:HCHO先和HN(CH3)2反应;第2步:产物再和A发生取代反应生成B。试写出第1步反应产物的结构简式 。
(5)已知: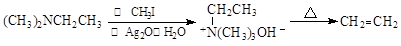 ,
,
写出以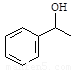 、HCHO、HN(CH3)2为有机原料,合成
、HCHO、HN(CH3)2为有机原料,合成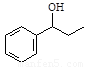 的合成路线流程图(无机试剂任用)。
的合成路线流程图(无机试剂任用)。
合成路线流程图示例如下: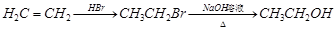
查看答案和解析>>
科目: 来源:2012-2013学年江苏省泰州市高三上学期期末考试化学试卷(解析版) 题型:实验题
废旧物的回收利用既有利于节约资源,又有利于保护环境。某研究小组同学以废旧锌锰干电池为原料,将废旧电池含锌部分转化成ZnSO4·7H2O,含锰部分转化成纯度较高的MnO2,将NH4Cl溶液应用于化肥生产中,实验流程如下:

(1)操作②中所用的加热仪器应选 (选填“蒸发皿”或“坩埚”)。
(2)将溶液A处理的第一步是加入氨水调节pH为9,使其中的Fe3+和Zn2+沉淀,请写出氨水和Fe3+反应的离子方程式 。
(3)操作⑤是为了除去溶液中的Zn2+。已知25℃时,
|
NH3·H2O的Kb |
Zn2+完全沉淀的pH |
Zn(OH)2溶于碱的pH |
|
1.8×10-5 |
8.9 |
>11 |
由上表数据分析应调节溶液pH最好为 (填序号)。
a.9 b.10 c.11
(4) MnO2精处理的主要步骤:
步骤1:用3%H2O2和6.0mol/L的H2SO4的混和液将粗MnO2溶解,加热除去过量H2O2,得MnSO4溶液(含少量Fe3+)。反应生成MnSO4的离子方程式为 ;
步骤2:冷却至室温,滴加10%氨水调节pH为6,使Fe3+沉淀完全,再加活性炭搅拌,抽滤。加活性炭的作用是 ;
步骤3:向滤液中滴加0.5mol/L的Na2CO3溶液,调节pH至7,滤出沉淀、洗涤、干燥,灼烧至黑褐色,生成MnO2。灼烧过程中反应的化学方程式为 。
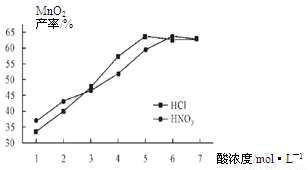
(5) 查文献可知,粗MnO2的溶解还可以用盐酸或者硝酸浸泡,然后制取MnCO3固体。
①在盐酸和硝酸溶液的浓度均为5mol/L、体积相等和最佳浸泡时间下,浸泡温度对MnCO3产率的影响如图4,由图看出两种酸的最佳浸泡温度都在 ℃左右;
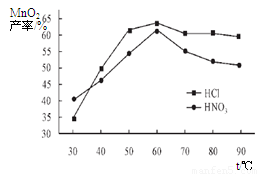
②在最佳温度、最佳浸泡时间和体积相等下,酸的浓度对MnCO3产率的影响如图5,由图看出硝酸的最佳浓度应选择 mol/L左右。
查看答案和解析>>
科目: 来源:2012-2013学年江苏省泰州市高三上学期期末考试化学试卷(解析版) 题型:实验题
某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
实验Ⅰ:制取NaClO2晶体
已知:NaClO2饱和溶液在温度低于38℃时析出晶体是NaClO2•3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。利用下图所示装置进行实验。
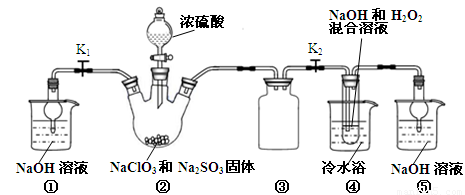
(1)装置③的作用是 。
(2)装置②中产生ClO2的化学方程式为 ;装置④中制备NaClO2的化学方程式为 。
(3)从装置④反应后的溶液获得NaClO2晶体的操作步骤为:
①减压,55℃蒸发结晶;②趁热过滤;③ ;④低于60℃干燥,得到成品。
实验Ⅱ:测定某亚氯酸钠样品的纯度。
设计如下实验方案,并进行实验:
①准确称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO2-+ 4I-+4H+ =2H2O+2I2+Cl-)。将所得混合液配成250mL待测溶液。
②移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol•L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得平均值为V mL(已知:I2 +2S2O32-=2I-+S4O62-)。
(4)达到滴定终点时的现象为 。
(5)该样品中NaClO2的质量分数为 (用含m、c、V的代数式表示)。
(6)在滴定操作正确无误的情况下,此实验测得结果偏高,原因用离子方程式表示为
。
查看答案和解析>>
科目: 来源:2012-2013学年江苏省泰州市高三上学期期末考试化学试卷(解析版) 题型:填空题
甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景。
(1)工业生产甲醇的常用方法是:CO(g)+2H2(g)  CH3OH(g)
△H = —90.8kJ/mol。
CH3OH(g)
△H = —90.8kJ/mol。
已知:2H2(g)+O2(g)=2H2O(l) △H = —571.6kJ/mol;
H2(g)+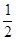 O2(g)=H2O(g)
△H = —241.8kJ/mol;
O2(g)=H2O(g)
△H = —241.8kJ/mol;
2CO(g)+O2(g)=2CO2(g) △H = —566.0kJ/mol
CH3OH(g) = CH3OH(l) △H = —37.3kJ/mol
①计算液体CH3OH的燃烧热为 。
②若在恒温恒容的容器内进行反应CO(g)+2H2(g)
 CH3OH(g),下列表示该反应达到平衡状态的标志有 (填字母序号)。
CH3OH(g),下列表示该反应达到平衡状态的标志有 (填字母序号)。
A.有1个H—H键生成的同时有 3个C—H键生成
B.CO百分含量保持不变
C.容器中混合气体的压强不变化
D.容器中混合气体的密度不变化
(2)制甲醇所需要的H2,可用下列反应制取:H2O(g)+CO(g)  H2(g)+
CO2(g) △H<0,某温度下该反应的平衡常数K=1。若起始时c(CO)=1mol•L-1,c(H2O)=2mol•L-1,试回答下列问题:
H2(g)+
CO2(g) △H<0,某温度下该反应的平衡常数K=1。若起始时c(CO)=1mol•L-1,c(H2O)=2mol•L-1,试回答下列问题:
①该温度下,反应进行一阶段时间后,测得H2的浓度为0.5mol•L-1,则此时该反应v(正) v(逆)(填“>”、“<”或“=”);
②若反应温度不变,达到平衡后,H2O的转化率为 。
(3)某实验小组设计了如右图7所示的甲醇燃料电池装置。
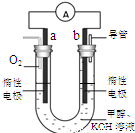
①该电池工作时,OH— 向 极移动(填“a”或“b”);
②工作一段时间后,测得溶液的pH减小,该电池负极反应的离子方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com