
科目: 来源:2012-2013学年山东省青岛市高三自评(二模)化学试卷(解析版) 题型:计算题
已知:Cu(OH)2是二元弱碱;亚磷酸(H3PO3)是二元弱酸,与NaOH溶液反应,生成Na2HPO3。
(1)在铜盐溶液中Cu2+发生水解反应的离子方程式为____,该反应的平衡常数为____;(已知:25℃时,Ksp[Cu(OH)2]=2.0×10-20mol3/L3)
(2)根据H3PO3的性质可推测Na2HPO3稀溶液的pH______7(填“>”“<”或“=”)。常温下,向10mL0.01mol/L H3PO3溶液中滴加10ml0.02mol/LNaOH溶液后,溶液中各种离子浓度由大到小的顺序是_________;
(3)电解Na2HPO3溶液可得到亚磷酸,装置如图(说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过)

①阳极的电极反应式为____________________。
②产品室中反应的离子方程式为____________。
查看答案和解析>>
科目: 来源:2012-2013学年山东省青岛市高三自评(二模)化学试卷(解析版) 题型:简答题
某校化学小组的同学将一批废弃的线路板简单处理后,得到Cu、Al、Fe及少量Au、Pt等金属的混合物,并设计了如下制备强酸铜和硫酸铝晶体的方案:

回答下列问题:
(1)第②步加入H2O2是为了除云Fe2+,该反应的离子方程式为_________;
(2)滤渣2的主要成分是Fe(OH)3和Al(OH)3。由滤渣2制取Al2(SO4)3·18H2O实验过程的最后步骤是__________________。
(3)用第③步所得CuSO4·5H2O可制得Cu(OH)2。化学活动小组为探究Cu(OH)2受热分解产物及产物性质,设计如下实验过程:取0.98g Cu(OH)2固体加热,有铜的氧化物生成,其质量随温度变化如图所示,产物A、B的化学式分别为____和Cu2O。通过以上实验和图像可以得出如下结论:高温时B______(填“较稳定”或“不稳定”)。

活动小组同学还进行了如下实验:
①甲同学用下列装置进行实验(夹持装置末画出),最终得出的结论是加热时A可将NH3氧化为N2,A被还原为单质Cu,支持甲同学结论的现象是______;

②乙同学用下列实验装置进行实验,实验中观察到混合粉末最终变成红色物质,同时生成一种无色、有刺激性气味的气体,该气体化学式为_______;有人认为乙同学的实验装置中在装B物质的试管与烧杯之间需加一个防倒吸装置,你认为是否有必要_____,若有必要请简述原因并加以改进____________。
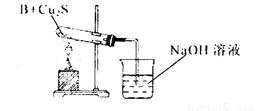
查看答案和解析>>
科目: 来源:2012-2013学年山东省青岛市高三自评(二模)化学试卷(解析版) 题型:简答题
化学肥料在农业生产中有重要作用。农业生产中,大量施用的化肥主要是氮肥、磷肥、钾肥。
(1)普钙是磷肥,它的有效成分是__________________(写化学式)。
(2)尿素是一种含氮量较高的氮肥,工业生产尿素是将氨气与二氧化碳在加压、加热的条件下反应生成氨基甲酸铵(H2NCOONH4),再使氨基甲酸铵脱水得到尿素。反应的化学方程式为_________、___________。
(3)某化肥厂用NH3制备NH4NO3,已知由NH3制NO的产率是96%、NO制HNO3的产率是92%,则制HNO3所用去NH3的质量占耗用全部NH3质量的__________%。
(4)合成氨气是生产氮肥的重要环节。合成氨生产简易流程示意图如下:
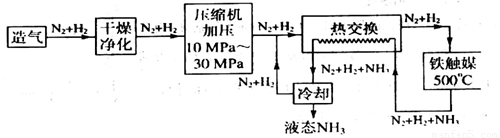
从示意图可知其存在循环操作。简要说明为什么在化工生产中经常采用循环操作___________。合成氨的反应需在500℃进行,其主要原因是_________。
查看答案和解析>>
科目: 来源:2012-2013学年山东省青岛市高三自评(二模)化学试卷(解析版) 题型:计算题
物质结构理论有助于人们理解物质变化的本质,进行分子设计和研究反应规律。请回答下列问题:
(1)第三周期基态原子有2个未成对电子且电负性最大的元素是_____;
(2)金属晶体受到外力作用时易发生形变,而离子晶体容易破裂。试从结构的角度分析其中的主要原因____________;
(3)已知在水中存在平衡2H2O=H3O++OH-。下列分子中,中心原子采取的杂化方式与H3O+中氧原子的杂化方式相同的是_____
a.CH2=CH2中的碳原子 b.NH2-中的氮原子
c.ClO3-中的氯原子 d.NO2-中的氮原子
(4)F、Mg、K三种元素形成的晶体晶胞结构如图所示,一个晶胞中Mg元素的质量分数为________。

查看答案和解析>>
科目: 来源:2012-2013学年山东省青岛市高三自评(二模)化学试卷(解析版) 题型:推断题
饮料果醋中含有苹果酸(MLA),其分子式为C4H6O5。0.1mol苹果酸与足量NaHCO3溶液反应能产生4.48LCO2(标准状况),苹果酸脱水能生成使溴水褪色的产物。苹果酸经聚合生成聚苹果酸(PMLA)。
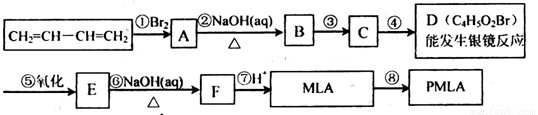
(1)写出下列物质的结构简式:B______,D______。
(2)MLA的核磁共振氢谱有____组峰。与MLA具有相同官能团的同分异构体有_____种。
(3)写出E→F转化的化学方程式______________。
(4)上述转化关系中步骤③和④的顺序能否颠倒______(填“能”或“不能”)说明理由:______________。
查看答案和解析>>
科目: 来源:2012-2013学年山东省高考重点命题预测系列化学试卷(解析版) 题型:选择题
化学已经渗透到人类生活的各个方面,下列说法不正确的是。
A. 高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,既能消毒杀菌又能净水。
B. “光化学烟雾”、“臭氧空洞”、“硝酸酸雨”的形成都与氮氧化合物有关
C. 低碳生活注重节能减排,尽量使用太阳能等代替化石燃料,减少温室气体的排放
D. 高纯度的硅单质广泛用于制作光导纤维,光导纤维遇强碱会“断路”。
查看答案和解析>>
科目: 来源:2012-2013学年山东省高考重点命题预测系列化学试卷(解析版) 题型:选择题
下列有关物质的性质与应用相对应的是
A.氢氟酸具有酸性,可用于雕刻玻璃
B.Na2O2具有强氧化性,可用作呼吸面具的供氧剂
C.氯化铁溶液能溶解氧化铜,可用于制作印刷电路板
D.SO2具有漂白性,可使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目: 来源:2012-2013学年山东省高考重点命题预测系列化学试卷(解析版) 题型:选择题
下列有关实验装置进行的相应实验,能达到实验目的的是
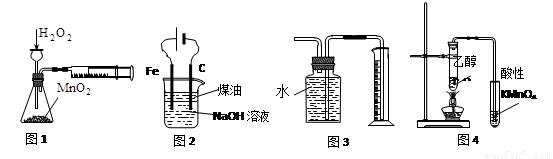
A.图1定量测定H2O2的分解速率
B.图2装置制备Fe(OH)2并能较长时间观察其颜色
C.图3装置测量Cu与浓硝酸反应产生气体的体积
D.图4证明CH3CH2OH发生消去反应生成了乙烯
查看答案和解析>>
科目: 来源:2012-2013学年山东省高考重点命题预测系列化学试卷(解析版) 题型:选择题
下列表示对应化学反应的离子方程式正确的是
A.NO2通入水中:3NO2+H2O=2H++2NO3-+NO
B.用两个铜电极电解CuSO4溶液:2Cu2++2H2O 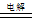 2Cu↓+O2↑+4H+
2Cu↓+O2↑+4H+
C.SO2通入FeCl3溶液中:SO2+Fe3++2H2O=SO42-+Fe2++4H+
D.过量的CO2通入NaAlO2溶液中:2AlO2-+CO2+3H2O =Al(OH)3↓+CO32-
查看答案和解析>>
科目: 来源:2012-2013学年山东省高考重点命题预测系列化学试卷(解析版) 题型:选择题
设NA表示阿伏加德罗常数的值,下列说法正确的是
A.常温常压下,5.6L CH4含C—H键数目为NA
B.常温常压下,100g 17%H2O2水溶液含氧原子总数为NA
C.标准状况下,5.6L O2与适量Na加热反应,转移电子数一定为NA
D.常温常压下,14g乙烯与丙烯的混合气体,含碳原子总数为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com