
科目: 来源:2012-2013学年山东省泰安市高三第二轮复习质量检测理综化学试卷(解析版) 题型:推断题
香豆素是一种用途广泛的香料,可以利用乙醇和B(分子式为C7H6O2)通过以下途径合成。

(1)D→E中①的反应类型为________________________________;
C中含氧官能团的名称为_________________________________。
(2)有关香豆素的说法正确的是___________________________(填字母)。
a.易溶于水和酒精中
b.长期放置香豆素,容易氧化变质
c.能发生加成反应,不能发生取代反应
d.1mol香豆素可与2molNaOH反应
(3)B有多种同分异构体,其中苯环上只有一个侧链的同分异构体的结构简式是________________(写一种即可)。
(4)乙醇生成A的化学方程式为__________________________。
查看答案和解析>>
科目: 来源:2012-2013学年山东省济南市高三4月巩固性训练理综化学试卷(解析版) 题型:选择题
下列说法中,正确的是
A.气象环境报告中新增的“PM2.5”是对一种新分子的描述
B.化学反应能够制造出新的物质,同时也能制造出新的元素
C.“光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化合物有关
D.明矾[KAl(SO4)2.12H2O]常用于自来水的净化、杀菌消毒
查看答案和解析>>
科目: 来源:2012-2013学年山东省济南市高三4月巩固性训练理综化学试卷(解析版) 题型:选择题
下列有关化学概念或原理的论述中,正确的是
A.Cl2、SO2、NH3的水溶液都能够导电,因此都属于电解质
B.任何一个氧化还原反应都可以设计为电池,输出电能
C.任何可逆反应,其平衡常数越大,反应速率、反应物的转化率就越大
D.电解饱和食盐水的过程中,水的电离平衡正向移动
查看答案和解析>>
科目: 来源:2012-2013学年山东省济南市高三4月巩固性训练理综化学试卷(解析版) 题型:选择题
下列关于有机物性质描述中,正确的是
A.用溴的四氯化碳溶液可鉴别CH4和C2H4。
B.苯与浓硫酸、浓硝酸的混合酸加热发生加成反应
C.乙酸、乙酸乙酯都可和NaOH溶液发生中和反应
D.葡萄糖、油脂、蛋白质一定条件下都可水解为小分子
查看答案和解析>>
科目: 来源:2012-2013学年山东省济南市高三4月巩固性训练理综化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数,下列结论能够成立的是
A.2L0.1mol/L的NaCO3溶液中含有CO32-的个数是0.2NA
B.1 molFe与足量稀硝酸完全反应转移的电子数为2NA
C.0.2mol/LCuSO4溶液加水稀释至体积增加l倍,其浓度变为0.1mol/L
D.常温下pH=5的H2SO3水溶液中c(H+):c(SO32-)=2:1
查看答案和解析>>
科目: 来源:2012-2013学年山东省济南市高三4月巩固性训练理综化学试卷(解析版) 题型:选择题
下列说法中,正确的是
A.H35Cl、H37Cl属于同素异形体
B.16O与18O的中子数不同,核外电子排布却相同
C.稳定性:CH4>SiH4;还原性:HCl>H2S
D.K+、Ca2+、Mg2+的离子半径依次增大,还原性依次增强
查看答案和解析>>
科目: 来源:2012-2013学年山东省济南市高三4月巩固性训练理综化学试卷(解析版) 题型:选择题
下列有关说法中,不正确的是
A.除去Fe(OH)3胶体中少量的NaCl,常用渗析的方法
B.实验室中少量金属钠、钾常保存在汽油中
C.中和滴定时要将滴定管洗净并用待盛溶液润洗2~3次
D.将盐酸、KSCN溶液和Fe(OH)3溶液混合后,溶液显红色
查看答案和解析>>
科目: 来源:2012-2013学年山东省济南市高三4月巩固性训练理综化学试卷(解析版) 题型:选择题
人体血液里存在如下平衡:CO2+H2O H2CO3
H2CO3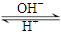 HCO3-使人体血液pH值保持在7.35~7.45之间,否则就会发生酸中毒或碱中毒。其pH值随c(HCO3-):c(H2CO3)变化关系如下表所示,则下列说法中正确的是
HCO3-使人体血液pH值保持在7.35~7.45之间,否则就会发生酸中毒或碱中毒。其pH值随c(HCO3-):c(H2CO3)变化关系如下表所示,则下列说法中正确的是
|
c(HCO3-):c(H2CO3) |
1.0 |
17.8 |
20.0 |
22.4 |
|
pH |
6.10 |
7.35 |
7.40 |
7.45 |
A.正常人体血液中,HCO3-的水解程度小于电离程度
B.人体发生酸中毒时,可饮用碳酸饮料缓解
C.pH=7.00的血液中,c(HCO3-)=c(H2CO3)
D.常温下pH=7.40的血液稀释至pH=7.35,c(H+)·c(OH-)一定不变
查看答案和解析>>
科目: 来源:2012-2013学年山东省济南市高三4月巩固性训练理综化学试卷(解析版) 题型:计算题
工业上由铝土矿(主要成分是Al2O3和Fe2O3)和焦炭制备无水AlCl3的流程如下

已知:AlCl3,FeCl3,分别在183℃、315℃升华
(1)在焙烧炉中发生反应:
①Fe2O3(s)+3C(s)  2Fe(s)+3CO(g) △H=-492.7kJ/mol
2Fe(s)+3CO(g) △H=-492.7kJ/mol
②3CO(g)+ Fe2O3(s)  2Fe(s)+3CO2(g) △H=+25.2kJ/mol
2Fe(s)+3CO2(g) △H=+25.2kJ/mol
反应2Fe2O3(s)+3C(s)
 4Fe(s)+3CO2(g) △H=___________kJ/mol。
4Fe(s)+3CO2(g) △H=___________kJ/mol。
(2)①Al2O3,Cl2和C在氯化炉中高温下发生反应,当生成1molAlCl3。时转移______mol电子;炉气中含有大量CO和少量Cl2,可用Na2SO3溶液除去Cl2,其离子方程式为:____________________________。在温度约为700℃向升华器中加入铝粉,发生反应的化学方程式为_______________。充分反应后温度降至____________以下(填“183℃、315℃之一),开始分离收集AlCl3。
②将AlCl3· 6H2O溶于浓硫酸进行蒸馏,也能得到一定量的无水AlCl3,此原理是利用浓硫酸下列性质中的____(填字母序号)。
①氧化性 ②吸水性 ③难挥发性 ④脱水性
a.只有① b.只有② c.只有②③ d.只有②③④
(3)海洋灯塔电池是利用铝、石墨为电极材料,海水为电解质溶液,构成电池的其正极反应式 ________;与铅蓄电池相比.释放相同电量时,所消耗金属电极材料的质量比m(Al):m(Pb)=_________________。
查看答案和解析>>
科目: 来源:2012-2013学年山东省济南市高三4月巩固性训练理综化学试卷(解析版) 题型:计算题
硫元素的化合物在生产、生活中有着广泛的应用。
(1)400℃,1.01× Pa下,容积为1.0L的密闭容器中充入0.5molSO2,
(g)和0.3 molO2 (g),发生反应2SO2(g)+O2(g)
Pa下,容积为1.0L的密闭容器中充入0.5molSO2,
(g)和0.3 molO2 (g),发生反应2SO2(g)+O2(g) 2SO3(g)
△H=-198kJ/mol。反应中n(SO3)和n(O2)随时间变化的关系如右图所示
2SO3(g)
△H=-198kJ/mol。反应中n(SO3)和n(O2)随时间变化的关系如右图所示 。反应的平衡常数K=_______;0到10 min内用SO2表示的平均反应速率_________。根据图中信息,判断下列叙述中正确的是_____(填序号)。
。反应的平衡常数K=_______;0到10 min内用SO2表示的平均反应速率_________。根据图中信息,判断下列叙述中正确的是_____(填序号)。
A.a点时刻的正反应速率比b点时刻的大
B.c点时刻反应达到平衡状态
C.d点和e点时刻的c(O2)相同
D.若5 00℃,1.01×105Pa下,反应达到平衡时,n( SO3) 比图中e点时刻的值大
(2)用NaOH溶液吸收工业废气中的SO2,当吸收液失去吸收能力时,25℃时测得溶液的pH=5.6,溶液中Na+,H+, HSO3-,SO32-离子的浓度由大到小的顺序是__________________。
(3)可通过电解法使(2)中的吸收液再生而循环利用(电极均为石墨电极),其工作示意图如下:

HSO3-在阳极室反应的电极反应式为________________________,阴极室的产物_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com