
科目: 来源:2012-2013学年山东省泰安市高三第二轮复习质量检测理综化学试卷(解析版) 题型:选择题
下图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是

A.原子半径:Z>Y>X
B.气态氢化物的稳定性:R<W
C.WX3和水反应生成的化合物是离子化合物
D.Y和Z两者最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目: 来源:2012-2013学年山东省泰安市高三第二轮复习质量检测理综化学试卷(解析版) 题型:选择题
下列说法正确的是
①明矾溶于水生成Al(OH)3胶体,可除去水中的悬浮颗粒杂质
②离子化合物中阴、阳离子间只存在静电吸引力
③CH3COONa、BaSO4都是强电解质
④向Na2SiO3溶液中通入CO2至过量,溶液先变浑浊后变澄清
⑤装强碱溶液的试剂瓶需要用橡胶塞,长时间后会在瓶口有白色固体生成
A.①④⑤ B.②③④ C.①③⑤ D.②③⑤
查看答案和解析>>
科目: 来源:2012-2013学年山东省泰安市高三第二轮复习质量检测理综化学试卷(解析版) 题型:选择题
钯的化合物PdCl2通过化学反应可用来检测有毒气体CO,该反应的反应物与生成物有CO、Pd、H2O、HCl、PdCl2和一种未知物质X。下列说法错误的是
A.未知物质X为CO2,属于氧化产物
B.每转移1mol e-时,生成2mol X
C.反应中PdCl2作氧化剂,被还原
D.还原性:CO>Pd
查看答案和解析>>
科目: 来源:2012-2013学年山东省泰安市高三第二轮复习质量检测理综化学试卷(解析版) 题型:选择题
用如图所示装置进行实验,下列叙述不正确的是
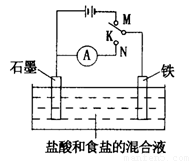
A.K与N连接时,铁被腐蚀
B.K与N连接时,石墨电极产生气泡
C.K与M连接时,一段时间后溶液的pH增大
D.K与M连接时,石墨电极反应:4OH--4e-=2H2O+O2↑
查看答案和解析>>
科目: 来源:2012-2013学年山东省泰安市高三第二轮复习质量检测理综化学试卷(解析版) 题型:选择题
下列说法正确的是
A.NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-)
B.浓度均为0.1mol·L-1的下列溶液,pH由大到小排列顺序为NaOH>Na2CO3>NaHSO4>(NH4)2SO4
C.pH=3的硫酸与醋酸溶液,c(SO42-)与c(CH3COO-)之比为1:2
D.向冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小
查看答案和解析>>
科目: 来源:2012-2013学年山东省泰安市高三第二轮复习质量检测理综化学试卷(解析版) 题型:计算题
近年来,以天然气等为原料合成甲醇的难题被一一攻克,极大地促进了甲醇化学的发展。
(1)与炭和水蒸气的反应相似,以天然气为原料也可以制得CO和H2,该反应的化学方程式为_________。
(2)合成甲醇的一种方法是以CO和H2为原料,其能量变化如图所示:
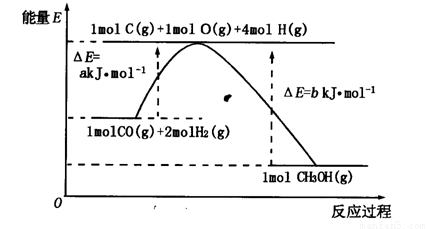
由图可知,合成甲醇的热化学方程式为________________________________________。
(3)以CO2为原料也可以合成甲醇,其反应原理为:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
①在lL的密闭容器中,充入1molCO2和3molH2,在500℃下发生反应,测得CO2(g)和CH3OH(g)的浓度随时问变化如图所示:
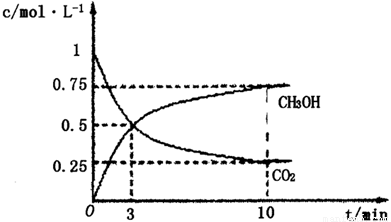
则下列说法正确的是_________________(填字母);
A.3min时反应达到平衡
B.0~10min时用H2表示的反应速率为0.225mol·-1·min-1
C.CO2的平衡转化率为25%
D.该温度时化学平衡常数为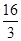 (mol/L)-2
(mol/L)-2
②在相同温度、相同容积的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
|
容器 |
容器1 |
容器2 |
容器3 |
|
反应物投入量(始态) |
1molCO2、3molH2 |
0.5molCO2、1.5molH2 |
1molCH3OH、1molH2O |
|
CH3OH的平衡浓度/mol•L-1 |
c1 |
c2 |
c3 |
|
平衡时体系压强/Pa |
p1 |
p2 |
p3 |
则下列各量的大小关系为c1___________c3,p2_________p3(填“大于”、“等于”或“小于”)。
(4)近年来,甲醇燃料电池技术获得了新的突破,如图所示为甲醇燃料电池的装置示意图。电池工作时,分别从b、c充入CH3OH、O2,回答下列问题:
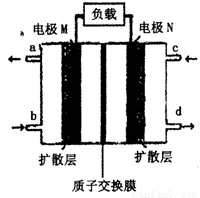
①从d处排出的物质是___________,溶液中的质子移向电极__________(填“M”或“N”);
②电极M上发生的电极反应式为__________________________。
查看答案和解析>>
科目: 来源:2012-2013学年山东省泰安市高三第二轮复习质量检测理综化学试卷(解析版) 题型:简答题
工业上常利用低品位软锰矿浆(主要成分是MnO2)来吸收含SO2的废气,最终制得硫酸锰晶体(MnSO4·H2O),其主要流程如下:

已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+等其他金属离子。有关金属离子形成氢氧化物沉淀时溶液的pH见下表:
|
离子 |
开始沉淀时的pH |
完全沉淀时的pH |
|
Fe2+ |
7.6 |
9.7 |
|
Fe3+ |
2.7 |
3.7 |
|
Al3+ |
3.8 |
4.7 |
|
Mn2+ |
8.3 |
9.8 |
(1)软锰矿浆中通入含SO2废气后,发生主要反应的化学方程式为____________________。
(2)浸出液中加入MnO2粉末的目的是____________;反应的离子方程式是___________________。
(3)溶液中加入石灰浆来调节pH,其作用是_________________;pH应调节的范围是__________。
(4)滤渣的主要成分是________________________________________________(用化学式表示)。
查看答案和解析>>
科目: 来源:2012-2013学年山东省泰安市高三第二轮复习质量检测理综化学试卷(解析版) 题型:实验题
铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与H2SO4反应)。有研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究。

实验一:铁矿石中含氧量的测定
a.按上图组装仪器(夹持仪器均省略),检查装置的气密性;
b.将5.0g铁矿石放入硬质玻璃管中;
c.从左端导气管口处不断地缓缓通入H2,待C装置出口处对H2验纯后,点燃A处酒精灯;
d.充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却。
(1)装置C的作用为_______________________________________________________。
(2)测得反应后装置B增重1.35g,则铁矿石中氧的质量分数为______________________。
实验二:铁矿石中含铁量的测定
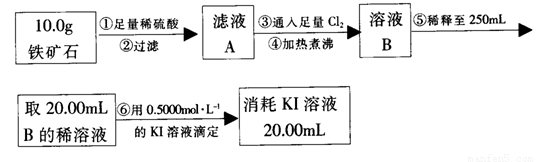
(3)步骤④中煮沸的目的是_____________________________________________。
(4)步骤⑤中用到的玻璃仪器有烧杯、胶头滴管、_________________________。
(5)下列有关步骤⑥的操作中说法不正确的是_______________________________。
a.滴定管用蒸馏水洗涤后再用待装液润洗
b.锥形瓶不需要用待测液润洗
c.因为碘水为黄色,所以滴定过程中不需加指示剂
d.滴定过程中可利用淀粉溶液作为指示剂
(6)铁矿石中铁的质量分数为______________________________________________。
实验结论:推算铁的氧化物的组成
(7)由实验一、二得出该铁矿石中铁的氧化物的化学式为____________________________。
查看答案和解析>>
科目: 来源:2012-2013学年山东省泰安市高三第二轮复习质量检测理综化学试卷(解析版) 题型:选择题
水处理主要包括水的净化、污水处理、硬水软化和海水淡化等。
(1)水处理技术的核心是减少或除去水中的各种杂质离子。目前,______________________和是主要的去离子方法。
(2)ClO2是一种性能优良的消毒剂,可将废水中少量的S2-、NO2-和CN-等有毒有害的还原性离子氧化除去。写出ClO2将废水中剧毒的CN-氧化成无毒气体的离子方程式______________________________。
(3)地下水往往含有钙、镁的碳酸盐,自来水厂需要对地下水进行____________处理。把进行过离子交换的CaR2(或MgR2)型树脂置于_______________中浸泡一段时间后便可再生。
(4)海水的淡化是除去海水中所含的盐分,如图是利用电渗析法由海水获得淡水的原理图。已知海水中含有Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极。
①阳离子交换膜是指_______________(填“A”或“B”);
②写出通电后阳极区的电极反应式____________。

查看答案和解析>>
科目: 来源:2012-2013学年山东省泰安市高三第二轮复习质量检测理综化学试卷(解析版) 题型:推断题
X、Y、Z、Q、W为按原子序数由小到大排列的五种短周期元素,已知:
①x元素与Q处于同一主族,其原子价电子排布式都为ns2np2,且x原子半径小于Q的原子半径;
②Y元素是地壳中含量最多的元素;w元素的电负性略小于Y元素;在w原子的电子排布中,P轨道上只有1个未成对电子;
③Z元素的电离能数据见下表(kJ·mol-1)
|
I1 |
I2 |
I3 |
I4 |
… |
|
496 |
4562 |
6912 |
9540 |
… |
(1)XY2分子空间构型为____________________________。QX的晶体结构与金刚石的相似,其中X原子的杂化方式为_______________,微粒间存在的作用力是____________。
(2)晶体ZW的熔点比晶体XW4明显高的原因是______________。
(3)氧化物MO的电子总数与QX的相等,则M为_____(填元素符号)。MO是优良的耐高温材料,其晶体结构与ZW晶体相似。MO的熔点比CaO的高,其原因是___________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com