
科目: 来源:2012-2013学年山东省泰安市高三3月第一轮复习质量检测化学试卷(解析版) 题型:选择题
二氧化碳和纳在一定条件下可制得金刚石,其化学方程式为3CO2+4Na=2X+C(金刚石)。设NA为阿伏加德罗常数的值,下列有关此反应的叙述中,不正确的是
A.1molC(金刚石)中含有C—C键数目为2NA
B.当有0.4molNa参与反应时,被还原的CO2为0.3NA
C.金刚石与石墨互为同素异形体
D.X的化学式为Na2CO3
查看答案和解析>>
科目: 来源:2012-2013学年山东省泰安市高三3月第一轮复习质量检测化学试卷(解析版) 题型:选择题
下列说法中,正确的是
A.酸性:盐酸>氢硫酸,则得电子能力:Cl>S
B.第二周期元素的最高正化合价从左到右依次升高
C.元素原子的最外层电子数越多,其氢化物稳定性越强
D.共价化合物中只存在共价键,离子化合物中一定含有离子键
查看答案和解析>>
科目: 来源:2012-2013学年山东省泰安市高三3月第一轮复习质量检测化学试卷(解析版) 题型:选择题
用选项中的电极、溶液和如图所示装置可组成原电池。下列现象或结论叙述正确的是
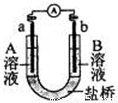
选项 电极a 电极b A溶液 B溶液 现象或结论
A Cu Zn CuSO4 ZnSO4 一段时间后,a增加的质量与b减少的质量相等
B Cu Zn 稀H2SO4 ZnSO4 盐桥中阳离子向b极移动
C C C FeCl3 KI、淀粉混
合液 b极附近溶液变蓝
D Fe C NaCl FeCl3 外电路电子转移方向:b→a
查看答案和解析>>
科目: 来源:2012-2013学年山东省泰安市高三3月第一轮复习质量检测化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.当温度升高时,弱酸的电离平衡常数Ka变小
B.某温度下的醋酸铵溶液呈中性,则溶液中必有c(H+)=c(OH-)=10-7mol·L-1
C.pH=12氨水与pH=2盐酸等体积混合,则溶液中c(Cl-)>c(NH4+)>c(H+)>c(OH-)
D.由Ksp(AgCl)>Ksp(AgI)可判断AgCl(s)+I-(aq)=AgI(s)+Cl-(aq)能发生
查看答案和解析>>
科目: 来源:2012-2013学年山东省泰安市高三3月第一轮复习质量检测化学试卷(解析版) 题型:选择题
化学中常用图像直观地描述化学反应的进程或结果。下列对图像描述叙述正确的是
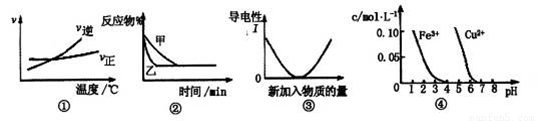
A.根据图①可判断可逆反应A2(g)+3B2(g)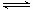 2AB3(g)的△H>0
2AB3(g)的△H>0
B.图②表示压强对可逆反应2A(g)+B(g)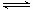 3C(g)+D(s)的影响,乙的压强大
3C(g)+D(s)的影响,乙的压强大
C.图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
D.据图④,若除去0.1mol·L-1CuSO4溶液中的Fe3+可向溶液中加入适量NaOH至pH约为5
查看答案和解析>>
科目: 来源:2012-2013学年山东省泰安市高三3月第一轮复习质量检测化学试卷(解析版) 题型:计算题
研究碳及其化合物的性质对促进低碳社会的构建具有重要意义。
(1)将不同量的CO(g)和H2O(g)分别通人体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g)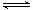 CO2(g)+H2(g),得到如下两组数据:
CO2(g)+H2(g),得到如下两组数据:
|
实验组 |
温度℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
||
|
CO |
H2O |
H2 |
CO |
|||
|
1 |
650 |
4 |
2 |
1.6 |
2.4 |
6 |
|
2 |
900 |
2 |
1 |
0.4 |
1.6 |
3 |
①实验1中以CO2表示的反应速率为_____________(保留2位小数);
②该反应为___________(填“吸热”或“放热”)反应;
③实验2的平衡常数为___________________________。
(2)已知在常温常压下:
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H=-1451.6kJ/mol
2CO(g)+O2(g)=2CO2(g) △H=-566.0kJ/mol
写出甲醇不完全燃烧生成CO和液态水的热化学方程式_______________________________。
(3)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,实验室用如图装置模拟该过程,其原理是:通电后,Co2+被氧化成Co3+,然后以Co3+做氧化剂把甲醇氧化成CO2而除去(Co3+的还原产物是CO2+)。
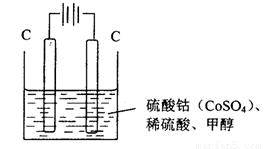
①写出阳极电极反应式_______________________________________________________________ ;
②写出除去甲醇的离子方程式__________________________________________________________。
查看答案和解析>>
科目: 来源:2012-2013学年山东省泰安市高三3月第一轮复习质量检测化学试卷(解析版) 题型:实验题
明矾石的主要成分是K2SO4·Al2(SO4)3·2Al2O3·6H2O,还含有少量Fe2O3杂质。利用明矾石制备氢氧化铝的流程如下:

(1)焙烧炉中发生反应的化学方程式为2Al2(SO4)3+3S 2Al2O3+9SO2,该反应的氧化剂是_______。若生成l molAl2O3,则转移的电子数为__________________。
2Al2O3+9SO2,该反应的氧化剂是_______。若生成l molAl2O3,则转移的电子数为__________________。
(2)熟料溶解时,反应的离子方程式为___________________________________________。
(3)母液中溶质主要成分的化学式为_____________________________________________。
(4)将标准状况下1.12L炉气通入100mL 0.5mol·L-1NaOH溶液中,得到一种酸性溶液,则该溶液中各种离子浓度由大到小的排列顺序为____________________________。
(5)检验废渣中主要成分的方法是_____________________________________________________(写出操作步骤、现象及结论)。
查看答案和解析>>
科目: 来源:2012-2013学年山东省泰安市高三3月第一轮复习质量检测化学试卷(解析版) 题型:实验题
硫酸铜是一种应用广泛的化工原料,实验室中可通过不同途径制取硫酸铜溶液和胆矾(CuSO4·5H2O),其中一种流程如下:

(1)操作I具体为__________、___________、过滤、烘干。
(2)杂铜(含少量有机物)灼烧后的产物除氧化铜还含少量铜,原因可能是___________(填字母代号)。
a.灼烧过程中部分氧化铜被还原
b.灼烧不充分.铜未被完全氧化
c.氧化铜在加热过程中分解生成铜
d.该条件下铜无法被氧气氧化
(3)若将杂铜换为纯净的铜粉,可直接向其中加入稀硫酸和Fe2(SO4)3溶液,不断通入氧气。反应完全后向其中加入过量_______________(填化学式,下同),调节pH至4,生成_________沉淀,过滤得硫酸铜溶液[已知Fe(OH)3和Cu(OH)2完全沉淀时的pH分别为3.7、6.4]。
(4)通过下述图1装置也可制取硫酸铜溶液(已知:2NaOH+2NO2=NaNO3+NaNO2+H2O)。

烧瓶内发生反应的离子方程式为____________________________________________;
图2是图1的改进装置,其优点有①__________________________,②_________________________。
查看答案和解析>>
科目: 来源:2012-2013学年山东省泰安市高三3月第一轮复习质量检测化学试卷(解析版) 题型:填空题
煤是重要的能源,也是化工生产的重要原料。
(1)煤燃烧产生的废气直接排放到空气中,可能导致的环境污染问题是_____________。
(2)下图是对煤矿燃烧产生的废气进行常温脱硫处理的流程示意图。

①废气脱硫过程中,主要反应的化学方程式为______________、_____________;
②在煤矿中直接添加一种物质,可有效减少煤矿燃烧产生的SO2,该物质是___________;
③石膏的工业生产中的用途是_________________(写出一种用途即可)。
(3)煤经过___________(填加工方法)可以得到焦炉煤气、煤矿焦油和焦炭。煤焦油经过_______(填加工方法)可得到芳得族化合物。煤矿也可以用氢化法转化燃油,氢化法的本质是__________________。
查看答案和解析>>
科目: 来源:2012-2013学年山东省泰安市高三3月第一轮复习质量检测化学试卷(解析版) 题型:填空题
物质的结构是决定物质性质的重要因素。请回答下列问题:
(1)基态Ni原子核外电子排布式为____________;第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是_________________。
(2)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分为0.069nm和0.078nm,则熔点NiO_____________FeO(填“<”或“>”);NiO晶胞中Ni2+的配位数为____________。
(3)肼可用作火箭燃料,燃烧时发生的反应是:N2O4+2N2H4=3N2+4H2O,若该反应中有4molN—H键断裂,形成的 键有________mol。
键有________mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com