
科目: 来源:2012-2013学年安徽省高三年级第二次联考理综化学试卷(解析版) 题型:选择题
已知t℃时,Ksp[Al(OH)3]=l×l0-33,Ksp[Mg(OH)2]=4×10-12。在含有0.20 mol/L H+且c(Mg2+)=c(A13+)=0.10mol/L的溶液中不断加入KOH溶液,沉淀的质量m(沉淀)与加入KOH溶液的体积V[KOH(aq)]关系的示意图正确的是( )

查看答案和解析>>
科目: 来源:2012-2013学年安徽省高三年级第二次联考理综化学试卷(解析版) 题型:填空题
X、Y、Z、W是短周期中常见元素,其相关信息如下表:
|
元素 |
相关信息 |
|
X |
X元素形成的一种同素异形体是天然晶体中硬度最大的单质 |
|
Y |
常温常压下,Y单质是淡黄色固体,用于制造黑火药 |
|
Z |
Z的基态原子核外有3个能级上有电子,且有3个单电子 |
|
W |
W元素形成的双原子分子,常温下为黄绿色气体,一种常见工业原料 |
(1)W元素位于元素周期表中第 周期 族,与Y同主族且位于第四周期元素的基态原子核外电子排布式为 。
(2)XY2分子中含有的σ键和π键个数比为 ,在相同条件下XY2与XO2相比,熔点较高的是 (填化学式)。结合相关理论解释Z所在族的元素第一电离能大于同周期后一族元素的原因: 。
(3)Y、W元素形成的化合物Y2W2和过量氢化物ZH3在无水条件下反应生成Y4Z4、单质Y8和一种可以作为化肥的物质,请写出相应化学方程式: 。
(4)已知:①lmolY(s)转化为气态Y(g) \吸收能量280 kJ;
②2XO(g)+O2(g)= 2XO2(g) ΔH=-566.0KJ/mol;
③Y(s)+O2(g)=YO2(g) ΔH=-299.0KJ/mol;一定条件下,可以利用X的氧化物XO和Y的氧化物YO2生成Y(g)单质和X的氧化物而达到消除污染目的。请写出该反应的热化学方程式: 。
查看答案和解析>>
科目: 来源:2012-2013学年安徽省高三年级第二次联考理综化学试卷(解析版) 题型:填空题
苯酚是重要的工业原料之一,工业上采用苯酚合成有机物D的路线如下:

请回答下列问题:
(1)有机物A分子官能团是 (写名称)。B的结构简式是 ,其核磁共振氢谱图中有 种峰。
(2)C→D的反应类型是 ,D与足量NaOH溶液共热时反应的化学方程式:
(3)X是B的同分异构体,X分子中含有苯环,其中苯环上一氯代物只有两种,且能发生银镜反应,则X的所有结构简式有 、
、 、
。
、
、 、
。
(4)有关化合物C的说法正确的是 (填字母)
A.能发生加成反应
B.一定条件下,可以在NaOH醇溶液中发生消去反应
C.1molC与足量NaOH溶液共热,最多消耗2molNaOH
D.属于酯类物质
查看答案和解析>>
科目: 来源:2012-2013学年安徽省高三年级第二次联考理综化学试卷(解析版) 题型:填空题
ZnO具有抗菌性,也是重要的轮胎添加剂。工业上由粗ZnO(含FeO、CuO)制备活性ZnO流程如下:
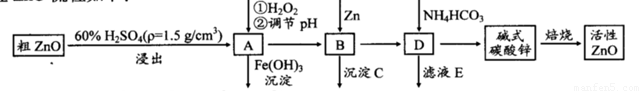
已知此溶液中Fe2+、Fe3+、Cu2+、Zn2+形成氢氧化物的pH如下表:
|
离子 |
开始沉淀的pH |
完全沉淀的pH |
|
Fe2+ |
6.4 |
8.4 |
|
Fe3+ |
2.4 |
3.1 |
|
Cu2+ |
5.2 |
6.7 |
|
Zn2+ |
6.8 |
9 |
(1)实验室中用98%H2SO4来配制100 mL60%稀硫酸所需使用的玻璃仪器有:烧杯、量筒、 、 、 。
(2)写出在A中加H2O2的离子方程式: 。
(3)向A中可以加入 (写化学式)调节溶液pH范围在 之间;沉淀C为 。
(4)碱式碳酸锌[Zn3(OH)4CO3·H2O]焙烧制备活性ZnO的化学方程式为 。
查看答案和解析>>
科目: 来源:2012-2013学年安徽省高三年级第二次联考理综化学试卷(解析版) 题型:实验题
甲、乙两个实验小组分别利用KMnO4酸性溶液与H2C2O4溶液反应进行研究外界因素对反应速率的影响。设计实验方案如下:
甲组:通过测定生成CO2气体体积的方法来比较化学反应速率的大小。
实验装置如图,实验时分液漏斗中A溶液一次性放入B溶液中

(注:实验中所用KMnO4溶液均已加人相同量H2SO4):
|
序号 |
A溶液 |
B溶液 |
|
① |
2 mL 0.1mol/LH2C2O4溶液 |
4 mL0.01mol/LKMnO4溶液 |
|
② |
2 mL 0.2mol/LH2C2O4溶液 |
4 mL0.01mol/LKMnO4溶液 |
(1)如何检查该装置的气密性: 。
(2)写出当锥形瓶中加入A溶液后发生的反应的离子方程式(提示:H2C2O4为弱酸): 。
(3)该实验探究的是 对化学反应速率的影响。分析所给实验仪器,实现该实验目的还欠缺的仪器: 。你将如何比较①②组化学反应速率大小?你的操作是 。
乙组:通过测定单位时间内KMnO4溶液浓度变化来判定反应速率快慢。
25℃时,40 mL 0.001mol/LKMnO4与38 mL0.1 mol/LH2C2O4和2 mL2.38mol/LH2SO4混合液共80 mL中KMnO4的浓度及对应时段的平均反应速率数据:
|
时间(min) |
4 |
8 |
12 |
16 |
21 |
22 |
23 |
24 |
25 |
|
c(KMnO4)(10-4mol/L) |
4.58 |
4.02 |
3.36 |
2.25 |
0.72 |
0.43 |
0.23 |
0.16 |
0.13 |
|
υ(KMnO4) (10-4mol/(L·min) |
υ |
0.14 |
0.17 |
0.28 |
0.32 |
0.29 |
0.20 |
0.07 |
0.03 |
(4)完成上表中υ= ×10-4mol/(L·min)。
问题讨论:已知该实验过程中溶液温度几乎不变,但是依据实验数据发现开始阶段速率却在增大。
①你认为引起该反应速率增大的因素是 。
②请设计实验证明你的观点,写出实验步骤及结论:
|
实验步骤及结论:
|
查看答案和解析>>
科目: 来源:2012-2013学年山东省临沂市高三9月月考化学式试卷(解析版) 题型:选择题
分类是化学学习和研究的常用手段。下列分类依据和结论都正确的是( )。
A.HClO、HNO3、浓H2SO4都具强氧化性,都是氧化性酸
B.H2O、HCOOH、Cu2(OH)2CO3均含有氧元素,都是氧化物
C.HF、CH3COOH、CH3CH2OH都易溶于水,都是电解质
D.HCOOH、H2CO3、H2SO4分子中均含有两个氢原子,都是二元酸
查看答案和解析>>
科目: 来源:2012-2013学年山东省临沂市高三9月月考化学式试卷(解析版) 题型:选择题
下图是某燃煤发电厂处理废气的装置示意图。装置内发生的主要反应中不含( )

A.化合反应 B.分解反应
C.置换反应 D.氧化还原反应
查看答案和解析>>
科目: 来源:2012-2013学年山东省临沂市高三9月月考化学式试卷(解析版) 题型:选择题
实验室中以下物质的贮存方法不正确的是( )
A.少量液溴可用水封存,防止溴挥发
B.少量金属钠保存在煤油中
C.浓硝酸用带橡胶塞的细口、棕色试剂瓶盛放,并贮存在阴凉处
D.保存硫酸亚铁溶液时,要向其中加入少量硫酸和铁粉
查看答案和解析>>
科目: 来源:2012-2013学年山东省临沂市高三9月月考化学式试卷(解析版) 题型:选择题
氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于阴影部分的是( )
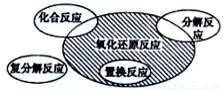
A.Cl2+2KBr=Br2+2KCl
B.2NaHCO3 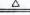 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
C.4Fe(OH)2+O2+2H2O=4Fe(OH)3
D.2Na2O2+2CO2=2Na2CO3+O2
查看答案和解析>>
科目: 来源:2012-2013学年山东省临沂市高三9月月考化学式试卷(解析版) 题型:选择题
设NA代表阿伏加德罗常数的数值,下列说法中正确的是( )
①常温常压下,17 g重甲基(-14CD3)所含的中子数为11NA;
②常温常压下,22.4 L NO气体的分子数小于NA;
③64 g铜发生氧化还原反应,一定失去2NA个电子;
④室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA;
⑤1 mol铁铝混合物与足量稀盐酸反应时,转移电子数是3 NA;
⑥常温常压下,1 mol氦气含有的核外电子数为4NA;
⑦6.8g熔融的KHSO4中含有的阳离子数为0.05 NA ;
A.①② B.③④⑦ C.②④⑦ D.②⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com