
科目: 来源:2011-2012学年山西省忻州一中高二(下)期中化学试卷(理科)(解析版) 题型:选择题
查看答案和解析>>
科目: 来源:2011-2012学年山西省忻州一中高二(下)期中化学试卷(理科)(解析版) 题型:选择题
查看答案和解析>>
科目: 来源:2011-2012学年山西省忻州一中高二(下)期中化学试卷(理科)(解析版) 题型:选择题

查看答案和解析>>
科目: 来源:2011-2012学年山西省忻州一中高二(下)期中化学试卷(理科)(解析版) 题型:选择题
| 表述Ⅰ | 表述Ⅱ | |
| A | 在水中,NaCl的溶解度比I2的溶解度大 | NaCl晶体中Cl-与Na+间的作用力大于碘晶体中分子间的作用力 |
| B | 通常条件下,CH4分子比SnH4分子稳定性大 | Sn的原子半径比C的大,Sn与H之间的键能比C与H间的键能小 |
| C | 在形成化合物时,同一主族元素的化合价相同 | 同一主族元素原子的最外层电子数相同 |
| D | P4O10、C6H12O6溶于水后均不导电 | P4O10、C6H12O6均属于共价化合物 |
查看答案和解析>>
科目: 来源:2011-2012学年山西省忻州一中高二(下)期中化学试卷(理科)(解析版) 题型:解答题
| ① | |||||||||||||||||
| ② | ③ | ④ | ⑤ | ⑥ | |||||||||||||
| ⑦ | ⑧ | ||||||||||||||||
| ⑨ | ⑩ |
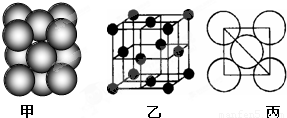
查看答案和解析>>
科目: 来源:2011-2012学年山西省忻州一中高二(下)期中化学试卷(理科)(解析版) 题型:解答题
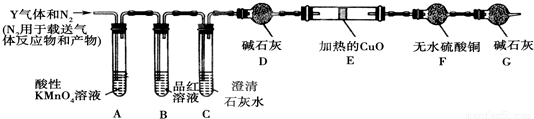
查看答案和解析>>
科目: 来源:2011-2012学年山西省忻州一中高二(下)期中化学试卷(理科)(解析版) 题型:解答题
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 |

查看答案和解析>>
科目: 来源:2010-2011学年北京市密云二中高二(下)期中化学试卷(解析版) 题型:选择题
查看答案和解析>>
科目: 来源:2010-2011学年北京市密云二中高二(下)期中化学试卷(解析版) 题型:选择题
查看答案和解析>>
科目: 来源:2010-2011学年北京市密云二中高二(下)期中化学试卷(解析版) 题型:选择题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com