相关习题
0 62354 62362 62368 62372 62378 62380 62384 62390 62392 62398 62404 62408 62410 62414 62420 62422 62428 62432 62434 62438 62440 62444 62446 62448 62449 62450 62452 62453 62454 62456 62458 62462 62464 62468 62470 62474 62480 62482 62488 62492 62494 62498 62504 62510 62512 62518 62522 62524 62530 62534 62540 62548 203614
科目:
来源:2010-2011学年山东省兖州市高二(下)期中化学试卷(解析版)
题型:选择题
现有四种元素的基态原子的电子排布式如下:
①1s22s22p63s23p4 ②1s22s22p63s23p3 ③1s22s22p3 ④1s22s22p5
则下列有关比较中正确的是( )
A.第一电离能:④>③>②>①
B.原子半径:④>③>②>①
C.电负性:④>③>②>①
D.最高正化合价:④>③=②>①
查看答案和解析>>
科目:
来源:2010-2011学年山东省兖州市高二(下)期中化学试卷(解析版)
题型:选择题
在乙烯分子中有5个σ键、1个π键,它们分别是( )
A.碳原子sp2杂化轨道形成σ键、未杂化的2p轨道形成π键
B.碳原子sp2杂化轨道形成π键、未杂化的2p轨道形成σ键
C.C-H之间是sp2杂化轨道形成的σ键,C-C之间是未参加杂化的2p轨道形成的π键
D.C-C之间是sp2杂化轨道形成的σ键,C-H之间是未参加杂化的2p轨道形成的π键
查看答案和解析>>
科目:
来源:2010-2011学年山东省兖州市高二(下)期中化学试卷(解析版)
题型:选择题
短周期金属元素甲~戊在元素周期表中的相对位置如右表所示.下列判断正确的是( )
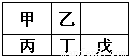
A.原子半径:丙<丁<戊
B.氢氧化物碱性:丙>丁>戊
C.金属性:甲>丙
D.最外层电子数:甲>乙
查看答案和解析>>
科目:
来源:2010-2011学年山东省兖州市高二(下)期中化学试卷(解析版)
题型:选择题
下列说法正确的是( )
A.元素周期表每一周期元素原子的最外层电子排布均是从ns1过渡到ns2np6
B.所有的非金属元素都分布在p区
C.原子核外电子排布式为1s1的原子与原子核外电子排布式为1s22s1的原子的化学性质相似
D.元素周期表中ⅢB到ⅡB的10个纵行的元素都是金属,所以统称过渡金属元素
查看答案和解析>>
科目:
来源:2010-2011学年山东省兖州市高二(下)期中化学试卷(解析版)
题型:选择题
下列说法正确的是( )
A.最外层电子排布为ns2的元素一定处于周期表ⅡA族
B.主族元素X、Y能形成XY2型化合物,则X与Y 的原子序数之差可能为2或5
C.亚硫酸的酸性比硫酸强
D.金属元素的电负性一定比非金属元素的电负性大
查看答案和解析>>
科目:
来源:2010-2011学年山东省兖州市高二(下)期中化学试卷(解析版)
题型:选择题
已知X、Y是主族元素,I为电离能,单位是kJ?mol
-1.请根据下表所列数据判断,错误的是( )
| 元素 | I1 | I2 | I3 | I4 |
| X | 500 | 4 600 | 6 900 | 9 500 |
| Y | 580 | 1 800 | 2 700 | 11 600 |
A.元素X的常见化合价是+1价
B.元素Y是ⅢA族元素
C.元素X与氯形成化合物时,化学式可能是XCl
D.若元素Y处于第三周期,它可与冷水剧烈反应
查看答案和解析>>
科目:
来源:2010-2011学年山东省兖州市高二(下)期中化学试卷(解析版)
题型:选择题
X、Y为两种元素的原子,X的阴离子与Y的阳离子具有相同的电子层结构,下列判断错误的是( )
A.X的电负性大于Y的电负性
B.X的原子半径大于Y的原子半径
C.X的氧化性大于Y的氧化性
D.X的第一电离能大于Y的第一电离能
查看答案和解析>>
科目:
来源:2010-2011学年山东省兖州市高二(下)期中化学试卷(解析版)
题型:选择题
能用键能知识加以解释的是( )
A.稀有气体的化学性质很不活泼
B.HCl比HI稳定
C.干冰易升华
D.冰比水的密度小
查看答案和解析>>
科目:
来源:2010-2011学年山东省兖州市高二(下)期中化学试卷(解析版)
题型:解答题
(1)以基态硅原子为例,如果电子排布式写作ls22s22p63s13p3则违反了______原理,如写作ls22s22p63s33p1则违反了______原理;
(2)已知H、C、Si三种元素的电负性依次为2.1、2.5、1.8,则CH4、SiH4中C、Si的化合价依次为______、______;
(3)在我们现今使用的元素周期表中,元素种类最多的族是______族,共______种元素;元素种类最多的周期是第______周期,共______种元素;
(4)熔点:F2______Cl2(填“<”或“=”“或>”,下同),沸点:HF______HCl,一定压强下HF和HCl的混合气体降温时______(填HF或HCl)先液化;
(5)前三周期元素中,基态原子中未成对电子数与其所在周期序数相同的元素:______(用元素符号按原子序数由小到大排列).
查看答案和解析>>
科目:
来源:2010-2011学年山东省兖州市高二(下)期中化学试卷(解析版)
题型:解答题
A、B、C、D、E、F都是短周期元素,原子序数依次增大,B、C、D同周期,A、E同主族.A、C能形成两种液态化合物甲和乙,原子个数比分别为2:1和1:1.B元素基态原子有两个未成对电子,D是周期表中电负性最大的元素,F是地壳中含量最多的金属元素.根据以上信息回答下列问题:
(1)D元素的名称为______,E的电子排布式为______;
(2)C、D、F的简单离子中,半径最小的是______(填离子符号);
(3)BA4的空间构型为______,B、C两元素形成的非极性分子的结构式为______;
(4)由这六种元素形成的单质和化合物中,可以相互反应生成H2的化学方程式为______,可以相互反应生成O2的化学方程式为______;
(5)下列关于甲和乙的说法中,错误的是______(填序号)
①乙分子中含有非极性键,一定是非极性分子
②甲的沸点较高与分子间形成氢键有关
③甲中中心原子采取sp2杂化
④乙在一定条件下可以分解生成甲
⑤甲分子中极性键的极性向量和为零.
查看答案和解析>>

