
科目: 来源:2012-2013学年江西省赣州十一县市高二(上)期中化学试卷(解析版) 题型:解答题
查看答案和解析>>
科目: 来源:2012-2013学年江西省赣州十一县市高二(上)期中化学试卷(解析版) 题型:解答题
| 滴定次数 | 待测溶液体积(mL) | 标准酸体积 | |
| 滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
| 第一次 | 10.00 | 0.40 | 20.50 |
| 第二次 | 10.00 | 4.10 | 24.00 |
| 第三次 | 10.00 | 0.40 | 21.50 |
查看答案和解析>>
科目: 来源:2012-2013学年江西省赣州十一县市高二(上)期中化学试卷(解析版) 题型:解答题
查看答案和解析>>
科目: 来源:2012-2013学年江西省赣州十一县市高二(上)期中化学试卷(解析版) 题型:解答题
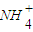 )______(填“>”“<”或“=”)c(Cl-).
)______(填“>”“<”或“=”)c(Cl-).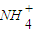 )______c(Cl-)(同上).
)______c(Cl-)(同上).查看答案和解析>>
科目: 来源:2012-2013学年江西省赣州十一县市高二(上)期中化学试卷(解析版) 题型:解答题
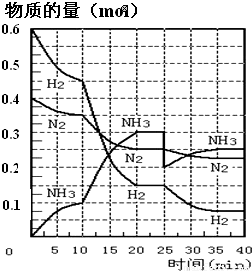
查看答案和解析>>
科目: 来源:2012-2013学年江西省赣州十一县市高二(上)期中化学试卷(解析版) 题型:解答题
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积 | 1×10-14 | a | 1×10-12 |
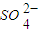 )=5×10-4 mol/L,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+):c(OH-)=______.
)=5×10-4 mol/L,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+):c(OH-)=______.查看答案和解析>>
科目: 来源:2012-2013学年山东省济宁市汶上一中高二(下)期末化学试卷(解析版) 题型:选择题
查看答案和解析>>
科目: 来源:2012-2013学年山东省济宁市汶上一中高二(下)期末化学试卷(解析版) 题型:选择题
查看答案和解析>>
科目: 来源:2012-2013学年山东省济宁市汶上一中高二(下)期末化学试卷(解析版) 题型:选择题
查看答案和解析>>
科目: 来源:2012-2013学年山东省济宁市汶上一中高二(下)期末化学试卷(解析版) 题型:选择题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com