
科目: 来源:2012-2013学年山东省临沂市某县高二(上)期中化学试卷(解析版) 题型:选择题
查看答案和解析>>
科目: 来源:2012-2013学年山东省临沂市某县高二(上)期中化学试卷(解析版) 题型:选择题
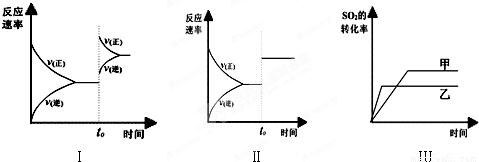
查看答案和解析>>
科目: 来源:2012-2013学年山东省临沂市某县高二(上)期中化学试卷(解析版) 题型:选择题
 O2(g)═ZnO(s)△H=-351.1kJ?mol-1
O2(g)═ZnO(s)△H=-351.1kJ?mol-1 O2(g)═HgO(s)△H=-90.7kJ?mol-1由此可知反应
O2(g)═HgO(s)△H=-90.7kJ?mol-1由此可知反应查看答案和解析>>
科目: 来源:2012-2013学年山东省临沂市某县高二(上)期中化学试卷(解析版) 题型:选择题
查看答案和解析>>
科目: 来源:2012-2013学年山东省临沂市某县高二(上)期中化学试卷(解析版) 题型:选择题
查看答案和解析>>
科目: 来源:2012-2013学年山东省临沂市某县高二(上)期中化学试卷(解析版) 题型:选择题
查看答案和解析>>
科目: 来源:2012-2013学年山东省临沂市某县高二(上)期中化学试卷(解析版) 题型:选择题
 O2(g)═H2O(g);△H=a kJ/mol
O2(g)═H2O(g);△H=a kJ/mol O2(g)═H2O(l);△H=c kJ/mol
O2(g)═H2O(l);△H=c kJ/mol查看答案和解析>>
科目: 来源:2012-2013学年山东省临沂市某县高二(上)期中化学试卷(解析版) 题型:解答题
 O2(g)=H2O(l)△H=-285.8kJ/mol,则C(s)与H2(g)、O2(g)反应生成CH3COOH(l)在该条件下的热化学方程式为______.
O2(g)=H2O(l)△H=-285.8kJ/mol,则C(s)与H2(g)、O2(g)反应生成CH3COOH(l)在该条件下的热化学方程式为______.查看答案和解析>>
科目: 来源:2012-2013学年山东省临沂市某县高二(上)期中化学试卷(解析版) 题型:解答题
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目: 来源:2012-2013学年山东省临沂市某县高二(上)期中化学试卷(解析版) 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com