
科目: 来源:2012-2013学年山东省淄博潍坊市高三(上)期末化学试卷(解析版) 题型:选择题
查看答案和解析>>
科目: 来源:2012-2013学年山东省淄博潍坊市高三(上)期末化学试卷(解析版) 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论或解释 |
| A | 向盛有0.5mol?L-1 Fe(NO3)2溶液的试管中加入0.5mol?L-1 H2SO4溶液 | 在试管口处出现红棕色气体 | 溶液中NO3-被Fe2+还原为NO2 |
| B | 向PbI2饱和溶液中滴加几滴0.1mol?L-1 KI溶液 | 出现黄色沉淀 | 说明 PbI2饱和溶液中有Pb2+存在 |
| C | 向白色ZnS沉淀上滴加0.1mol?L-1 CuSO4溶液,振摇 | 沉淀变为黑色 | ZnS沉淀转化为CuS沉淀 ZnS(s)+Cu2+(aq)=CuS(s)+Zn2+(aq) |
| D | 用1mol?L-1醋酸溶液和1mol?L-1盐酸分别做导电性实验 | 醋酸溶液对应的灯泡较暗 | 醋酸是弱电解质 |
查看答案和解析>>
科目: 来源:2012-2013学年山东省淄博潍坊市高三(上)期末化学试卷(解析版) 题型:填空题


查看答案和解析>>
科目: 来源:2012-2013学年山东省淄博潍坊市高三(上)期末化学试卷(解析版) 题型:填空题
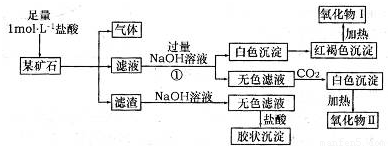
查看答案和解析>>
科目: 来源:2012-2013学年山东省淄博潍坊市高三(上)期末化学试卷(解析版) 题型:填空题
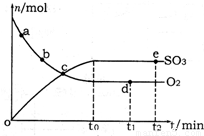
查看答案和解析>>
科目: 来源:2012-2013学年山东省淄博潍坊市高三(上)期末化学试卷(解析版) 题型:填空题
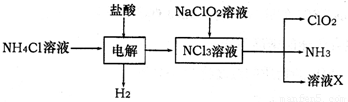
 NCl3+3H2↑;假设NCl3中氮元素为+3价.
NCl3+3H2↑;假设NCl3中氮元素为+3价.查看答案和解析>>
科目: 来源:2012-2013学年山东省淄博潍坊市高三(上)期末化学试卷(解析版) 题型:填空题
| 化合价 | -2 | -1 | 0 | +2 | +4 | +6 | +7 |
| 代表物的化学式 | FeS2 | S | Na2S2O3 | SO3或H2SO4或Na2SO4 | Na2S2O8 |
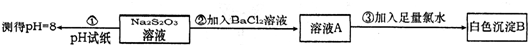
查看答案和解析>>
科目: 来源:2012-2013学年浙江省温州市十校联考高一(上)期末化学试卷(解析版) 题型:选择题



查看答案和解析>>
科目: 来源:2012-2013学年浙江省温州市十校联考高一(上)期末化学试卷(解析版) 题型:选择题
查看答案和解析>>
科目: 来源:2012-2013学年浙江省温州市十校联考高一(上)期末化学试卷(解析版) 题型:选择题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com