相关习题
0 62712 62720 62726 62730 62736 62738 62742 62748 62750 62756 62762 62766 62768 62772 62778 62780 62786 62790 62792 62796 62798 62802 62804 62806 62807 62808 62810 62811 62812 62814 62816 62820 62822 62826 62828 62832 62838 62840 62846 62850 62852 62856 62862 62868 62870 62876 62880 62882 62888 62892 62898 62906 203614
科目:
来源:2009-2010学年浙江省台州市高二(下)期末化学试卷(解析版)
题型:选择题
向Cr2(SO4)3的水溶液中加入NaOH溶液,当pH=4.6时,开始出现Cr(OH)3沉淀,随着pH的升高,沉淀增多;但当pH>13时,沉淀消失,出现亮绿色的亚铬酸根离子(CrO22-).其平衡关系如下:
Cr3+(紫色)+3OH-?Cr(OH)3(灰绿色)?CrO22-(亮绿色)+H++H2O
向0.05mo1?L-1 Cr2(SO4)3溶液50mL中,加入1.0mol?L-1NaOH溶液50mL,充分反应后,溶液中可观察到的现象是( )
A.溶液为紫色
B.溶液中有灰绿色沉淀
C.溶液为亮绿色
D.无法判断
查看答案和解析>>
科目:
来源:2009-2010学年浙江省台州市高二(下)期末化学试卷(解析版)
题型:选择题
下图装置中,U型管内为红墨水,a,b试管内分别盛有食盐水和稀醋酸溶液,各加入生铁块,放置一段时间后,下列有关描述正确的是( )
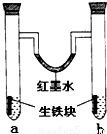
A.红墨水柱两边的液面变化是左高右低
B.b试管中溶液pH值减小
C.两试管中相同的电极反应式是:Fe-3e
-=Fe
3+D.a试管中阳极反应式为:O
2+2H
2O-4e
-=4OH
-
查看答案和解析>>
科目:
来源:2009-2010学年浙江省台州市高二(下)期末化学试卷(解析版)
题型:选择题
下列叙述中,正确的是( )
A.中和10mL 0.1 mol?L-1HAc与中和100mL 0.01 mol?L-1HAc所需NaOH的物质的量不同
B.10mL 0.1 mol?L-1氨水与100mL 0.01 mol?L-1氨水,其OH-物质的量相同
C.相同条件下,将pH值相同的盐酸和醋酸稀释相同的倍数,盐酸pH值变化较大
D.锌分别与pH=3的盐酸和pH=3的醋酸溶液反应,起始反应速率盐酸较快
查看答案和解析>>
科目:
来源:2009-2010学年浙江省台州市高二(下)期末化学试卷(解析版)
题型:选择题
下列离子方程式书写错误的是( )
A.氧化铝溶于强碱溶液中:3H
2O+Al
2O
3+2OH
-=2Al(OH)
4-B.在苯酚钠溶液中通入CO
2气体:2C
6H
5O
-+H
2O+CO
2→2C
6H
5OH+CO
32-C.用惰性电极电解硫酸铜溶液:2Cu
2++2H
2O

2Cu+O
2↑+4H
+D.在海带中提取碘元素时,在滤液中加入适量的稀硫酸和双氧水:2H
++2I
-+H
2O
2=I
2+2H
2O
查看答案和解析>>
科目:
来源:2009-2010学年浙江省台州市高二(下)期末化学试卷(解析版)
题型:选择题
下列实验操作正确的是( )
A.纸层析法分离铁离子和铜离子的实验中,应将滤纸上的试样点浸入展开剂中
B.硝酸钾晶体的制备实验中,蒸发浓缩硝酸钠和氯化钾的混合溶液,氯化钠晶体析出后趁热过滤,承接滤液的烧杯应预先加蒸馏水,以防降温氯化钠溶液达饱和而析出
C.海带中碘元素的分离及检验的实验中,将海带灰用蒸馏水浸泡,煮沸2~3 min,取其浸取液,向其中加入四氯化碳萃取其中的碘
D.乙醇的脱水反应(制乙烯)实验中,反应的温度应控制在170℃,温度计的水银球应处于支管口处
查看答案和解析>>
科目:
来源:2009-2010学年浙江省台州市高二(下)期末化学试卷(解析版)
题型:选择题
在固定体积的密闭容器中,发生:N
2(g)+3H
2(g)?2NH
3(g)△H=-92.2kJ?mo1
-1,右图表示在时间t
~t
7中反应速率与反应过程的曲线图,则容器内氨的百分含量最高的一段时间是(只改变单一的条件)( )

A.t
~t
1B.t
2~t
3C.t
4~t
5D.t
6~t
7
查看答案和解析>>
科目:
来源:2009-2010学年浙江省台州市高二(下)期末化学试卷(解析版)
题型:选择题
下列各溶液中,微粒的物质的量浓度关系不正确的是( )
A.0.1 mol?L-1NaHCO3溶液中:c(H2CO3)>c(CO32-)
B.0.1 mol?L-1Na2CO3溶液中:c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
C.0.1 mol?L-1的NH4Cl溶液与0.05 mol?L-1的NaOH溶液等体积混合,其混合溶液中:c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+)
D.浓度均为0.1 mol?L-1的NH4Cl、CH3COONH4、NH4HCO3溶液的pH大小顺序:pH(CH3COONH4)>pH(NH4HCO3)>pH(NH4Cl)
查看答案和解析>>
科目:
来源:2009-2010学年浙江省台州市高二(下)期末化学试卷(解析版)
题型:选择题
完全燃烧一定质量的无水甲醇生成CO2 和水蒸气放出热量为Q,已知为了完全吸收生成的CO2,消耗8mol?L-1NaOH溶液50mL,则完全燃烧1mol无水甲醇产生CO2气体和液态水放出的热量不可能是( )
A.5Q
B.小于2.5Q
C.大于5Q
D.2.5Q~5Q
查看答案和解析>>
科目:
来源:2009-2010学年浙江省台州市高二(下)期末化学试卷(解析版)
题型:解答题
已知拆开1mol氢气中的化学键需要消耗436kJ能量,拆开1mol氧气中的化学键需要消耗498kJ能量,根据图中的能量图,回答下列问题:
(1)分别写出①②的数值:
①______; ②______.
(2)生成H
2O(g)中的1mol H-O键放出______kJ的能量.
(3)已知:H
2O(l)=H
2O(g)△H=+44kJ?mol
-1,试写出氢气在氧气中完全燃烧生成液态水的热化学方程式:______.

查看答案和解析>>
科目:
来源:2009-2010学年浙江省台州市高二(下)期末化学试卷(解析版)
题型:填空题
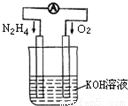
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义.
(1)发射卫星时可用肼(N
2H
4)作燃料,其方程式为:
N
2H
4+O
2=N
2+2H
2O,若将此反应设计成如右图所示的原电池装置,请回答:
①负极反应式为:
;
②工作一段时间后正极附近溶液的pH变化为
(填“增大”“减小”或“不变”);
③若用该电池电解以石墨为电极的100mL氯化铜溶液,一段时间后,两极均收集到2.24L气体(已换算成标准状况下的体积),则原溶液中Cu
2+的物质的量浓度为
.
(2)在25℃时,向浓度均为0.1mol?L
-1的MgCl
2和CuCl
2 混合溶液中逐滴加入氨水,首先生成
沉淀(填化学式),生成该沉淀的离子方程式为
.(已知25℃K
sp[Mg(OH)
2]=1.8×10
-11,K
sp[Cu(OH)
2]=2.2×10
-20).
(3)在25℃时,将a mol?L
-1的氨水与0.01mol?L
-1的盐酸等体积混合,反应平衡时溶液中c(NH
4+)=c(Cl
-),则溶液显
性(填“酸”“碱”或“中”),用含a的代数式表示NH
3?H
2O的电离常数k
b=
.
查看答案和解析>>


 2Cu+O2↑+4H+
2Cu+O2↑+4H+

