
科目: 来源:2010-2011学年北京市房山区高三(上)期末化学试卷(解析版) 题型:选择题
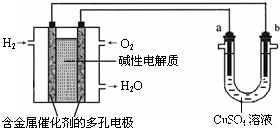
查看答案和解析>>
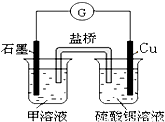
科目: 来源:2010-2011学年北京市房山区高三(上)期末化学试卷(解析版) 题型:选择题
查看答案和解析>>
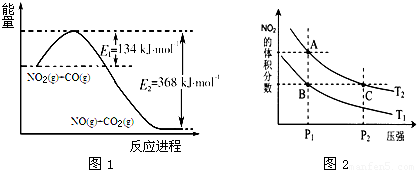
科目: 来源:2010-2011学年北京市房山区高三(上)期末化学试卷(解析版) 题型:填空题

查看答案和解析>>
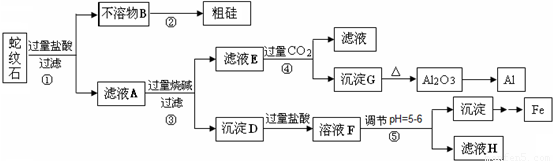
科目: 来源:2010-2011学年北京市房山区高三(上)期末化学试卷(解析版) 题型:解答题
| 元素 | 有关信息 |
| A | 最高价氧化物对应的水化物与其氢化物反应生成离子化合物 |
| B | 地壳中含量最多的元素 |
| C | 单质须保存在煤油中 |
| D | 单质与NaOH溶液反应可用于生产漂白液 |
| E | 单质是生活中用量最大的金属,其制品在潮湿空气中易被腐蚀或损坏 |
查看答案和解析>>
科目: 来源:2010-2011学年北京市房山区高三(上)期末化学试卷(解析版) 题型:解答题

查看答案和解析>>
科目: 来源:2010-2011学年北京市房山区高三(上)期末化学试卷(解析版) 题型:解答题
| T/K | 298 | 398 | 498 |
| 平衡常数K | 4.1×106 | K1 | K2 |
 ,则N2的转化率a(N2)=______,以NH3表示该过程的反应速率v(NH3)=______.
,则N2的转化率a(N2)=______,以NH3表示该过程的反应速率v(NH3)=______.查看答案和解析>>
科目: 来源:2010-2011学年北京市房山区高三(上)期末化学试卷(解析版) 题型:解答题
| 金属阳离子 | 氢氧化物开始沉淀时的pH | 氢氧化物完全沉淀时的pH |
| Fe3+ | 1.9 | 3.2 |
| Mg2+ | 9.4 | 11.6 |
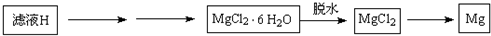
查看答案和解析>>
科目: 来源:2010-2011学年北京市房山区高三(上)期末化学试卷(解析版) 题型:解答题
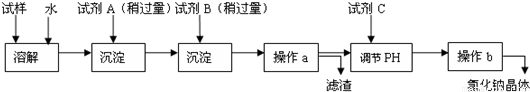
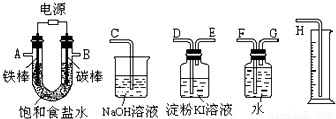
查看答案和解析>>
科目: 来源:2010-2011学年北京市房山区高三(上)期末化学试卷(解析版) 题型:解答题
| [资料] | 溴水是溴单质的水溶液,因溶有溴单质而呈黄色. |
| 试剂 | 酚酞试液、CCl4、无水酒精、KSCN溶液 | ||
| 方案 | 操作步骤 | 实验现象 | 结论 |
| 1 | 取所述黄色溶液于试管中,滴加______并振荡 | 溶液变红色 | 反应______所致 |
| 2 | 取所述黄色溶液于试管中,滴加______并振荡 | ______ | ----------- |
查看答案和解析>>
科目: 来源:2010-2011学年北京市房山区高三(上)期末化学试卷(解析版) 题型:解答题
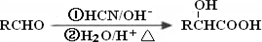
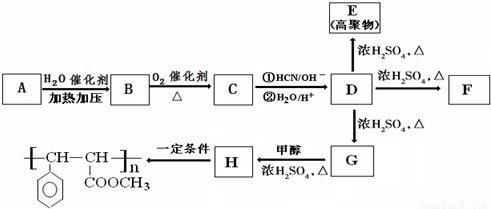
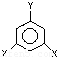 (其中X、Y均不为H);
(其中X、Y均不为H);查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com