
科目: 来源: 题型:多选题
查看答案和解析>>
科目: 来源: 题型:解答题
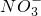 +10H++8e-→N2O+5H2O
+10H++8e-→N2O+5H2O查看答案和解析>>
科目: 来源: 题型:多选题
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验方法 | 实验现象 | 结 论 |
| 分别向A、B溶液中加 KSCN溶液 | ______ | 固体物质中有FeCl3 |
| 分别向KMnO4溶液中 加适量A、B溶液 | KMnO4溶液颜色无明显变化 | 固体物质中不含______ |
| 氢氧化物 开始沉淀时的pH | 氢氧化物 沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Fe2+ | 7.0 | 9.0 |
| Cu2+ | 4.7 | 6.7 |
| 提供的药品:Cl2、浓H2SO4、NaOH溶液、CuO、Cu | ||
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:单选题
 下列有关实验原理或实验操作正确的是
下列有关实验原理或实验操作正确的是查看答案和解析>>
科目: 来源: 题型:单选题
| 泡腾片 |
每片含: 碳酸钙 500mg 维生素 1000mg 柠檬酸 1350mg |
| 用量… |
| 用法… |
查看答案和解析>>
科目: 来源: 题型:单选题
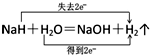
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com