
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
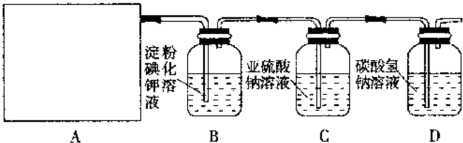
 氨气具有还原性,一定条件下,氨气可与氧化铜反应,反应后得到三种物质,其中有两种单质,如图所示为该反应的部分反应装置(夹持装置略).请回答:
氨气具有还原性,一定条件下,氨气可与氧化铜反应,反应后得到三种物质,其中有两种单质,如图所示为该反应的部分反应装置(夹持装置略).请回答:查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
 现象:溶液显紫色;另取该溶液滴入Na2CO3溶液中,无明显现象.
现象:溶液显紫色;另取该溶液滴入Na2CO3溶液中,无明显现象. 现象:溶液显蓝色;另取该溶液滴入Na2CO3溶液中的现象为______;有关反应的离子方程式为______.
现象:溶液显蓝色;另取该溶液滴入Na2CO3溶液中的现象为______;有关反应的离子方程式为______.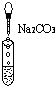 现象:有气泡产生,有关反应的离子方程式为______;另取该溶液滴入试剂X,
现象:有气泡产生,有关反应的离子方程式为______;另取该溶液滴入试剂X,查看答案和解析>>
科目: 来源: 题型:解答题
 3Ba↑+BaO?Al2O3.常温下Al的金属性比Ba的金属性______(选填“强”“弱”).利用上述方法可制取Ba的主要原因是______.
3Ba↑+BaO?Al2O3.常温下Al的金属性比Ba的金属性______(选填“强”“弱”).利用上述方法可制取Ba的主要原因是______.查看答案和解析>>
科目: 来源: 题型:单选题
 已知:还原性HSO-3>I-,氧化性IO-3>I2.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如右图所示.下列有关说法正确的是
已知:还原性HSO-3>I-,氧化性IO-3>I2.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如右图所示.下列有关说法正确的是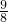 mol
mol查看答案和解析>>
科目: 来源: 题型:解答题
 Fe2O3+3H2O
Fe2O3+3H2O
| 反应前 | 反应后 | |
| Ⅰ 组 | 玻璃管和红色粉末的总质量为37.3g | 玻璃管和固体物质的总质量为36.1g |
| Ⅱ 组 | 洗气瓶和所盛溶液 的总质量为180.0g | 洗气瓶和瓶中物质 的总质量为183.1g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com