
科目: 来源:2011-2012学年浙江省温州市十校联考高二(下)期中化学试卷(解析版) 题型:选择题
查看答案和解析>>
科目: 来源:2011-2012学年浙江省温州市十校联考高二(下)期中化学试卷(解析版) 题型:选择题
查看答案和解析>>
科目: 来源:2011-2012学年浙江省温州市十校联考高二(下)期中化学试卷(解析版) 题型:选择题
查看答案和解析>>
科目: 来源:2011-2012学年浙江省温州市十校联考高二(下)期中化学试卷(解析版) 题型:选择题
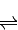 H++CH3COO-,下列叙述不正确的( )
H++CH3COO-,下列叙述不正确的( )查看答案和解析>>
科目: 来源:2011-2012学年浙江省温州市十校联考高二(下)期中化学试卷(解析版) 题型:选择题
查看答案和解析>>
科目: 来源:2011-2012学年浙江省温州市十校联考高二(下)期中化学试卷(解析版) 题型:选择题

查看答案和解析>>
科目: 来源:2011-2012学年浙江省温州市十校联考高二(下)期中化学试卷(解析版) 题型:选择题
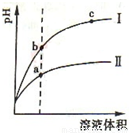
查看答案和解析>>
科目: 来源:2011-2012学年浙江省温州市十校联考高二(下)期中化学试卷(解析版) 题型:填空题
| 阳离子 | Na+、K+、Cu2+ |
| 阴离子 | SO42-、OH- |
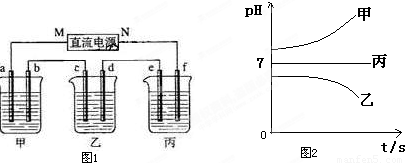
查看答案和解析>>
科目: 来源:2011-2012学年浙江省温州市十校联考高二(下)期中化学试卷(解析版) 题型:填空题
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 20.00 | 0.50 | 25.40 |
| 第二次 | 20.00 | 4.00 | 29.10 |
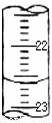
查看答案和解析>>
科目: 来源:2011-2012学年浙江省温州市十校联考高二(下)期中化学试卷(解析版) 题型:填空题
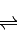 2SO3(g)△H=-196.6kJ?mol-1
2SO3(g)△H=-196.6kJ?mol-1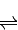 2NO2(g)△H=-113.0kJ?mol-1
2NO2(g)△H=-113.0kJ?mol-1 SO3(g)+NO(g)的△H= kJ?mol-1.
SO3(g)+NO(g)的△H= kJ?mol-1.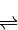 CH3OH(g).
CH3OH(g).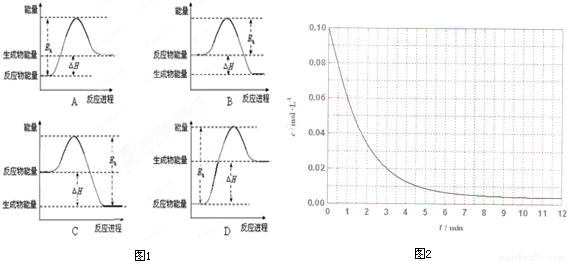
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com