
科目: 来源:2010-2011学年浙江省杭州市七校联考高二(下)期中化学试卷(解析版) 题型:选择题
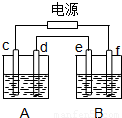
查看答案和解析>>
科目: 来源:2010-2011学年浙江省杭州市七校联考高二(下)期中化学试卷(解析版) 题型:选择题

查看答案和解析>>
科目: 来源:2010-2011学年浙江省杭州市七校联考高二(下)期中化学试卷(解析版) 题型:填空题
| 时间(s) | 20 | 40 | 60 | 80 | |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
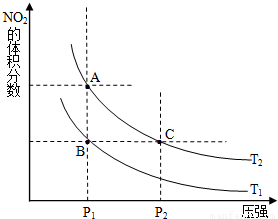
查看答案和解析>>
科目: 来源:2010-2011学年浙江省杭州市七校联考高二(下)期中化学试卷(解析版) 题型:填空题
查看答案和解析>>
科目: 来源:2010-2011学年浙江省杭州市七校联考高二(下)期中化学试卷(解析版) 题型:填空题
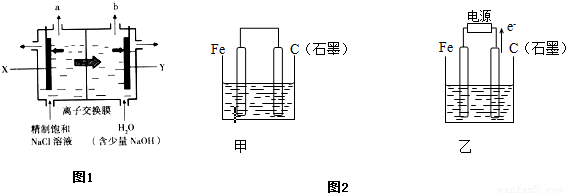
查看答案和解析>>
科目: 来源:2010-2011学年浙江省杭州市七校联考高二(下)期中化学试卷(解析版) 题型:填空题
| 催化剂 时间(g) 质量(g) | 0.1g MnO2 | 0.1g CuO |
| 0s | 192.500 | 192.500 |
| 5s | 192.180 | 192.420 |
| 10s | 192.020 | 192.380 |
| 15s | 191.940 | 192.360 |
| 20s | 191.940 | 192.352 |
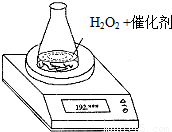
查看答案和解析>>
科目: 来源:2010-2011学年浙江省杭州市七校联考高二(下)期中化学试卷(解析版) 题型:解答题
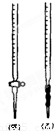
查看答案和解析>>
科目: 来源:2010-2011学年浙江省杭州市七校联考高二(下)期中化学试卷(解析版) 题型:填空题
| 温度/℃ | K1 | K2 |
| 500 | 1.00 | 3.15 |
| 700 | 1.50 | 2.25 |
| 900 | 2.50 | 1.50 |
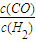 的值最大.
的值最大.查看答案和解析>>
科目: 来源:2010-2011学年浙江省杭州市七校联考高二(下)期中化学试卷(解析版) 题型:填空题
查看答案和解析>>
科目: 来源:2010-2011学年山东省济南市历城区高一(上)期中化学试卷(解析版) 题型:选择题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com