相关习题
0 62893 62901 62907 62911 62917 62919 62923 62929 62931 62937 62943 62947 62949 62953 62959 62961 62967 62971 62973 62977 62979 62983 62985 62987 62988 62989 62991 62992 62993 62995 62997 63001 63003 63007 63009 63013 63019 63021 63027 63031 63033 63037 63043 63049 63051 63057 63061 63063 63069 63073 63079 63087 203614
科目:
来源:2011-2012学年浙江省温州市苍南县七校联考高二(下)期中化学试卷(解析版)
题型:选择题
下列关于反应能量的说法正确的是( )
A.若反应A=B;△H<O,说明A物质具有的能量比B物质具有的能量高,A比B稳定
B.101kPa时,2H2(g)+O2(g)═2H2O(g)△H=-QkJ?mol-1,则H2的燃烧热为1/2QkJ?mol-l
C.H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ.mol-1,含1mol NaOH的氢氧化钠溶液与含0.5mol H2SO4的浓硫酸混合后放出57.3kJ
D.Zn(s)+CuSO4(aq)═ZnSO4(aq)+Cu(s),△H=-216kJ?mol-1,则反应物总能量大于生成物总能量
查看答案和解析>>
科目:
来源:2011-2012学年浙江省温州市苍南县七校联考高二(下)期中化学试卷(解析版)
题型:选择题
等质量的两份锌粉a、b分别加入到两份质量相同的过量的稀硫酸中,同时向a中加入少量的CuSO
4溶液,下列各图为产生H
2的体积V(L)与时间t(min)的关系,其中正确的是( )
A.
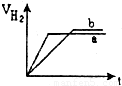
B.
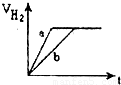
C.
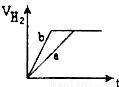
D.
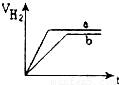
查看答案和解析>>
科目:
来源:2011-2012学年浙江省温州市苍南县七校联考高二(下)期中化学试卷(解析版)
题型:选择题
对于Zn(s)+H
2SO
4(aq)=ZnSO
4(aq)+H
2(g)△H<0 的化学反应下列叙述不正确的是( )
A.反应过程中能量关系如图所示

B.若将其设计为电池当有32.5g锌溶解时,正极放出气体一定为11.2L
C.△H的值与反应方程式的计量系数有关
D.若将该反应设计成原电池锌为负极
查看答案和解析>>
科目:
来源:2011-2012学年浙江省温州市苍南县七校联考高二(下)期中化学试卷(解析版)
题型:选择题
有两只串联的电解池(惰性电极),甲池盛有CuSO4溶液,池盛有一定量某硝酸盐的稀溶液.电解时当甲池电极析出6.4gCu时,乙池电极析出2.4g金属,则乙池的溶质可能是( )
A.Ca(NO3)2
B.AgNO3
C.Al(NO3)3
D.Mg(NO3)2
查看答案和解析>>
科目:
来源:2011-2012学年浙江省温州市苍南县七校联考高二(下)期中化学试卷(解析版)
题型:选择题
用石墨电极在一定温度下电解K
2SO
4饱和溶液m g.当阴极产生a mol气体时,从溶液中析出n g无水晶体.则剩余溶液的溶质质量分数是( )
A.

B.

C.

D.

查看答案和解析>>
科目:
来源:2011-2012学年浙江省温州市苍南县七校联考高二(下)期中化学试卷(解析版)
题型:选择题
反应:①PCl5(g)?PCl3(g)+Cl2(g) ②2HI(g)?H2(g)+I2(g) ③2NO2(g)?N2O4(g)在一定条件下,达到化学平衡时,反应物的转化率均是 a%.若保持各反应的温度和容器的体积都不改变,分别再加入一定量的各自的反应物,则转化率( )
A.均不变
B.①增大,②不变,③减少
C.①减少,②不变,③增大
D.均增大
查看答案和解析>>
科目:
来源:2011-2012学年浙江省温州市苍南县七校联考高二(下)期中化学试卷(解析版)
题型:选择题
下列对化学平衡移动的分析中,不正确的是( )
①已达平衡的反应C(s)+H2O(g)?CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
②已达平衡的反应N2(g)+3H2(g)?2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
③有气体参加的反应平衡时,若减小反应器容积时,平衡一定向气体体积增大的方向移动
④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动.
A.①④
B.①②③
C.②③④
D.①②③④
查看答案和解析>>
科目:
来源:2011-2012学年浙江省温州市苍南县七校联考高二(下)期中化学试卷(解析版)
题型:选择题
T℃时,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如右图所示,下列描述正确的是( )
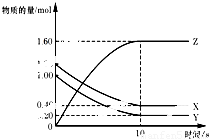
A.平衡时X、Y的转化率相同
B.达到平衡后,将容器体积扩大为4L,平衡逆向移动
C.平衡时X的正反应速率与Y的逆反应速率相等
D.T℃时,该反应的化学方程式为:X(g)+Y(g)?2Z(g),平衡常数K=40
查看答案和解析>>
科目:
来源:2011-2012学年浙江省温州市苍南县七校联考高二(下)期中化学试卷(解析版)
题型:选择题
一定条件下,可逆反应C(s)+CO2(g)?2CO(g)△H>0,达到平衡状态,现进行如下操作:①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积:④减少体系中CO的量.上述措施中一定能使反应的正反应速率显著加快的( )
A.①③
B.①②③④
C.④②
D.①③④
查看答案和解析>>
科目:
来源:2011-2012学年浙江省温州市苍南县七校联考高二(下)期中化学试卷(解析版)
题型:选择题
已知25℃时有关弱酸的电离平衡常数:
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7
K2=5.6×10-11 |
根据上述电离常数分析,下列错误的是( )
A.25℃时,等物质的量浓度的各溶液pH关系为:pH(HCN)>pH(H
2CO
3)>pH(CH
3COOH)
B.2NaCN+H
2O+CO
2=2HCN+Na
2CO
3C.a mol/L HCN溶液与b mol/L NaOH溶液等体积混合后,所得溶液中c(Na
+)=c(CN
-),则a一定大于b
D.2CH
3COOH+Na
2CO
3=2 CH
3COONa+H
2O+CO
2↑
查看答案和解析>>










