相关习题
0 62951 62959 62965 62969 62975 62977 62981 62987 62989 62995 63001 63005 63007 63011 63017 63019 63025 63029 63031 63035 63037 63041 63043 63045 63046 63047 63049 63050 63051 63053 63055 63059 63061 63065 63067 63071 63077 63079 63085 63089 63091 63095 63101 63107 63109 63115 63119 63121 63127 63131 63137 63145 203614
科目:
来源:2012-2013学年湖北省荆州市沙市中学高二(上)期中化学试卷(解析版)
题型:选择题
化学用语是学习化学的重要工具,下列化学用语中,正确的是( )
A.NH4+的水解反应离子方程式:NH4++H2O?NH3?H2O+H+
B.在AgCl悬浊液中加入KI溶液充分振荡:Ag++I-=AgI↓
C.镀铜时,阳极的电极反应式为:Cu2++2e-═Cu
D.某反应△H<0,则该反应在任意条件下均可自发进行
查看答案和解析>>
科目:
来源:2012-2013学年湖北省荆州市沙市中学高二(上)期中化学试卷(解析版)
题型:选择题
下列说法正确的是( )
A.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大
B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大
C.升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数
D.催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率
查看答案和解析>>
科目:
来源:2012-2013学年湖北省荆州市沙市中学高二(上)期中化学试卷(解析版)
题型:选择题
下列说法正确的是( )
A.H2(g)的燃烧热△H=-285.8 kJ/mol,则2H2O(g)═2H2(g)+O2(g)△H=+571.6 kJ/mol
B.反应物的总能量低于生成物的总能量时,该反应为放热反应
C.由石墨比金刚石稳定可知:C(金刚石,s)=C(石墨,s)△H<0
D.已知:298 K时,N2(g)+3H2(g)?2NH3(g)△H=-92.0 kJ/mol.在相同温度下,向密闭容器中通入0.5 mol N2和1.5 mol H2,达到平衡时放出46.0 kJ的热量
查看答案和解析>>
科目:
来源:2012-2013学年湖北省荆州市沙市中学高二(上)期中化学试卷(解析版)
题型:选择题
下列关于电解的说法正确的是( )
A.二次电池充电过程的实质是电解,充电时应将其负极与充电器电源的负极相连
B.电镀时,通常把待镀的金属制品作阳极
C.电解法精炼铜时,其含有的Zn、Fe、Ni、Ag、Au等杂质沉积在电解槽的底部
D.工业上通常用电解饱和食盐水生产金属钠,电解熔融氯化铝冶炼铝
查看答案和解析>>
科目:
来源:2012-2013学年湖北省荆州市沙市中学高二(上)期中化学试卷(解析版)
题型:选择题
下列现象与电化学腐蚀无关的是( )
A.黄铜(铜锌合金)制作的铜锣不易产生铜绿
B.生铁比软铁心(几乎是纯铁)容易生锈
C.铁制器件附有铜质配件,在接触处易生锈
D.银质奖牌在空气中久置后表面变暗
查看答案和解析>>
科目:
来源:2012-2013学年湖北省荆州市沙市中学高二(上)期中化学试卷(解析版)
题型:选择题
在下列溶液中,各组离子一定能够大量共存的是( )
A.使酚酞试液变红的溶液:Na+、Cl-、SO42-、Fe3+
B.使紫色石蕊试液变红的溶液:Na+、Fe2+、NO3-、Cl-
C.c(H+)=10-12mol?L-1的溶液:K+、Ba2+、Cl-、Br-
D.碳酸氢钠溶液:K+、SO2-4、Cl-、H+
查看答案和解析>>
科目:
来源:2012-2013学年湖北省荆州市沙市中学高二(上)期中化学试卷(解析版)
题型:选择题
常温下,向0.1mol?L
-1的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验时不同阶段的溶液,下列有关说法中正确的是( )
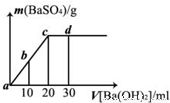
A.溶液的导电能力:a<b<d<c
B.溶液的pH:a<b<c<d
C.a溶液和b溶液呈碱性
D.d处沉淀的量比c处的大
查看答案和解析>>
科目:
来源:2012-2013学年湖北省荆州市沙市中学高二(上)期中化学试卷(解析版)
题型:选择题
能影响水的电离平衡,并使溶液中的c(H+)>c(OH-)的操作是( )
A.向水中投入一小块金属钠
B.将水加热煮沸
C.向水中通入二氧化碳气体
D.向水中加食盐晶体
查看答案和解析>>
科目:
来源:2012-2013学年湖北省荆州市沙市中学高二(上)期中化学试卷(解析版)
题型:选择题
高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大.以下是某温度下这四种酸在冰醋酸(无水醋酸)中的电离常数:从下表格中判断下列说法正确的是( )
| 酸 | HClO4 | H2SO4 | HCl | HNO3 |
| Ka | 1.6×10-5 | 6.3×10-9 | 1.6×10-9 | 4.2×10-10 |
A.水对于这四种酸的强弱没有区分能力,但醋酸可以区别这四种酸的强弱
B.在冰醋酸中高氯酸是这四种酸中最弱的酸
C.在冰醋酸中硫酸的电离方程式为H
2SO
4=2H
++SO
42-D.在冰醋酸和水中这四种酸都没有完全电离
查看答案和解析>>
科目:
来源:2012-2013学年湖北省荆州市沙市中学高二(上)期中化学试卷(解析版)
题型:选择题
今有室温下四种溶液,有关叙述不正确的是( )
| ① | ② | ③ | ④ |
| pH | 11 | 11 | 3 | 3 |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
A.①、②中分别加入适量的氯化铵晶体后,两溶液的pH均减小
B.分别加水稀释10倍,四种溶液的pH ①>②>④>③
C.①、④两溶液等体积混合,所得溶液中c(Cl
-)>c(NH
4+)>c(OH
-)>c(H
+)
D.V
aL④与V
bL②溶液混合后,若混合后溶液pH=4,则V
a:V
b=11:9
查看答案和解析>>

