相关习题
0 62952 62960 62966 62970 62976 62978 62982 62988 62990 62996 63002 63006 63008 63012 63018 63020 63026 63030 63032 63036 63038 63042 63044 63046 63047 63048 63050 63051 63052 63054 63056 63060 63062 63066 63068 63072 63078 63080 63086 63090 63092 63096 63102 63108 63110 63116 63120 63122 63128 63132 63138 63146 203614
科目:
来源:2012-2013学年福建省八县(市)一中联考高二(上)期中化学试卷(解析版)
题型:选择题
将右图所示实验装置的K闭合,下列判断正确的是( )
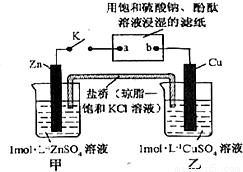
A.片刻后可观察到滤纸b点变红色
B.电子沿Zn→a→b→Cu路径流动
C.片刻后甲池中c(SO
42-)增大
D.Cu电极上发生还原反应
查看答案和解析>>
科目:
来源:2012-2013学年福建省八县(市)一中联考高二(上)期中化学试卷(解析版)
题型:选择题
爱迪生电池在充电和放电时发生的反应:Fe+NiO2+2H2O?Fe(OH)2+Ni(OH)2,下列该蓄电池推断正确的是( )
①放电时,Fe参与负极反应,NiO2参与正极反应
②充电时,阴极上的电极反应式为:Fe(OH)2+2e-=Fe+2OH-
③放电时,电解质溶液中的阴离子向正极方向移动
④放电时,负极上的电极反应式为:Fe+2H2O-2e-=Fe(OH)2+2H+
⑤蓄电池的电极必须浸入某种碱性电解质溶液中.
A.①②⑤
B.①②④
C.④⑤
D.①③
查看答案和解析>>
科目:
来源:2012-2013学年福建省八县(市)一中联考高二(上)期中化学试卷(解析版)
题型:选择题
用CH4催化还原NOx可以消除氮氧化物的污染.
例①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=-1160kJ/mol,
下列说法不正确的是( )
A.由反应①可推知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l);△H<-574kJ/mol
B.等物质的量的甲烷分别参加反应①、②,反应转移的电子数不同
C.若用标准状况下4.48L CH4还原NO2至NO,放出的热量为114.8kJ
D.若用标准状况下4.48L CH4还原NO2至N2,整个过程中转移的电子总数为1.6mol
查看答案和解析>>
科目:
来源:2012-2013学年福建省八县(市)一中联考高二(上)期中化学试卷(解析版)
题型:填空题
(1)经测定,20g氢气在氧气中燃烧生成水蒸气,放热2418.0kJ,写出该反应的热化学方程式
;已知:3Fe (s)+2O
2(g)═Fe
3O
4(s)△H=-1118.4kJ?mol
-1,根据以上信息,则反应 3Fe(s)+4H
2O(g)═Fe
3O
4(s)+4H
2(g) 的△H=
(2)某学生实验小组用50mL0.50mol?L
-1的盐酸与50mL0.50mol?L
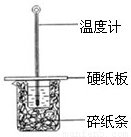
-1的NaOH溶液在右图所示的装置中进行中和反应反应热的测定
①图中装置缺少的一种仪器,该仪器名称为
.
②将反应混合液的
温度记为反应的终止温度.
③下列说法正确的是
A.小烧杯内残留有水,会使测得的反应热数值偏小
B.可用相同浓度和体积的醋酸代替稀盐酸溶液进行实验
C.烧杯间填满碎纸条的作用是固定小烧杯
D.酸、碱混合时,应把量筒中的溶液缓缓倒入烧杯的溶液中,以防液体外溅.
查看答案和解析>>
科目:
来源:2012-2013学年福建省八县(市)一中联考高二(上)期中化学试卷(解析版)
题型:填空题
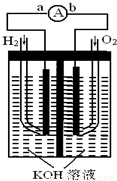
氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
(1)氢氧燃料电池的能量转化主要形式是
,在导线中电子流动方向为
(用a、b表示).
(2)负极反应式为
.
(3)电极表面镀铂粉的原因为
.
(4)该电池工作时,H
2和O
2连续由外部供给,电池可连续不断提供电能.因此,大量安全储氢是关键技术之一.金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H
2
2LIH;
Ⅱ.LiH+H
2O═LiOH+H
2↑
①反应Ⅰ中的还原剂是
,反应Ⅱ中的氧化剂是
.
②用锂吸收224L(标准状况)H
2,生成的LiH与H
2O作用后放出的H
2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为
mol.
(5)肼一空气燃料电池是一种碱性电池,该电池放电时,肼作
极,其电极反应式为(生成无污染物质)
.
查看答案和解析>>
科目:
来源:2012-2013学年福建省八县(市)一中联考高二(上)期中化学试卷(解析版)
题型:填空题
超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层.科学家正在研究利用催化技术将尾气中的NO和CO转变成CO
2和N
2,其反应为:2NO(g)+2CO(g)
2CO
2(g)+N
2(g).
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得密闭容器中不同时间的NO和CO浓度如表:
| 时间(s) | | 1 | 2 | 3 | 4 | 5 |
c(NO)
(mol/L) | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
c(CO)
(mol/L) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)在上述条件下反应能够自发进行,则反应的△H
0(填写“>”、“<”、“=”).
(2)该反应的化学平衡常数表达式为K=
.
(3)前2s内的平均反应速率v(N
2)=
.
(4)能判断该反应是否达到化学平衡状态的依据是
(多选扣分).
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ
正(N
2)=υ
逆(CO) d.c(CO
2)=c(CO)
(5)该温度下达到平衡时CO的转化率是
.
查看答案和解析>>
科目:
来源:2012-2013学年福建省八县(市)一中联考高二(上)期中化学试卷(解析版)
题型:填空题
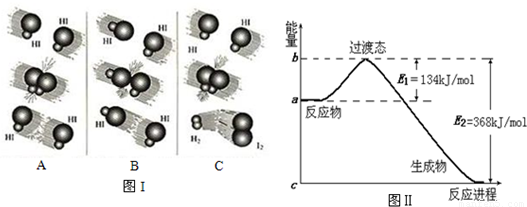
1918年,Lewis提出反应速率的碰撞理论:反应物分子间的相互碰撞是反应进行的必要条件,但并不是每次碰撞都能引起反应,只有少数碰撞才能发生化学反应.能引发化学反应的碰撞称之为有效碰撞
(1)图I是HI分解反应中HI分子之间的几种碰撞示意图,其中属于有效碰撞的是
(选填“A”、“B”或“C”);
(2)图Ⅱ是NO
2和CO反应生成CO
2和NO过程中能量变化示意图,请写出NO
2和CO反应的热化学方程式:
;
(3)E
1的大小对该反应的反应热有无影响?
.(选填“有”或“无”)
(4)进一步研究表明,化学反应的能量变化(△H)与反应物和生成物的键能有关.键能可以简单的理解为断开1 mol 化学键时所需吸收的能量.下表是部分化学键的键能数据:
| 化学键 | C-H | Cl-Cl | C-Cl | H-Cl |
| 键能/kJ?mol-1 | X | 243 | 330 | 432 |
已知:反应CH
4(g)+Cl
2(g)=CH
3Cl(g)+HCl(g);△H=-106kJ/mol,则上表中X=
.
查看答案和解析>>
科目:
来源:2012-2013学年福建省八县(市)一中联考高二(上)期中化学试卷(解析版)
题型:填空题
某实验小组以H
2O
2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2% H2O2溶液 | 无 |
| ② | 10mL5% H2O2溶液 | 无 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol?L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol?L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol?L-1FeCl3溶液 |
(1)催化剂能加快化学反应速率的原因是
.
(2)实验①和②的目的是
.实验时由于较长时间没有观察到明显现象而无法得出结论.资料显示,通常条件下H
2O
2稳定,不易分解.为了达到实验目的,你对原实验方案的改进是
.
(3)写出实验③的化学反应方程式
.
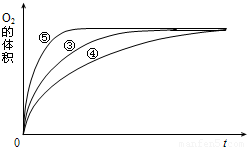
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图.分析上图能够得出的实验结论是
.
查看答案和解析>>
科目:
来源:2012-2013学年湖北省荆州市沙市中学高二(上)期中化学试卷(解析版)
题型:选择题
废电池造成污染的问题日益受到关注.下列有关电池的说法正确的是( )
A.构成原电池的正极和负极必须是两种不同的金属
B.弱电解质在水中的电离程度很小,不能用作电池的电解质溶液
C.原电池是将化学能完全转变为电能的装置
D.回收废旧电池,可防止汞、镉和铅等重金属对土壤和水源的污染
查看答案和解析>>
科目:
来源:2012-2013学年湖北省荆州市沙市中学高二(上)期中化学试卷(解析版)
题型:选择题
下列不属于自发过程的是( )
A.石墨转化为金刚石
B.NaCl溶于水后的扩散
C.铁生锈
D.Zn与CuSO4溶液反应
查看答案和解析>>



 2LIH;
2LIH;
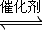 2CO2(g)+N2(g).
2CO2(g)+N2(g).
