相关习题
0 62963 62971 62977 62981 62987 62989 62993 62999 63001 63007 63013 63017 63019 63023 63029 63031 63037 63041 63043 63047 63049 63053 63055 63057 63058 63059 63061 63062 63063 63065 63067 63071 63073 63077 63079 63083 63089 63091 63097 63101 63103 63107 63113 63119 63121 63127 63131 63133 63139 63143 63149 63157 203614
科目:
来源:2011-2012学年浙江省温州市高二(下)期中化学试卷(解析版)
题型:选择题
现有物质的量浓度均为0.1mol/L的下列5种物质的水溶液:①HNO3②H2SO4③CH3COOH ④NaOH其溶液中由水电离出的c(H+)的大小关系是( )
A.③>①=④>②
B.③=①=④>②
C.②>①>③>④
D.③>①>④>②
查看答案和解析>>
科目:
来源:2011-2012学年浙江省温州市高二(下)期中化学试卷(解析版)
题型:选择题
化学反应C(s)+H
2O(g)
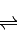
CO(g)+H
2(g)△H>0达到平衡,下列叙述正确的是( )
A.减小压强,平衡向正反应方向移动
B.升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动
C.加入水蒸气使容器压强增大,平衡向逆反应方向移动
D.加入固体碳,平衡向正反应方向移动
查看答案和解析>>
科目:
来源:2011-2012学年浙江省温州市高二(下)期中化学试卷(解析版)
题型:选择题
在相同温度下,100mL 0.01mol/L醋酸与10mL 0.1mol/L醋酸相比,下列数值前者大于后者的是( )
A.中和时所需NaOH的量
B.电离程度
C.H+浓度
D.醋酸的物质的量
查看答案和解析>>
科目:
来源:2011-2012学年浙江省温州市高二(下)期中化学试卷(解析版)
题型:选择题
在密闭容器中发生反应aA(g)?cC(g)+dD(g)达平衡后,保持温度不变,将容器体积压缩到原来的一半.当达到新的平衡时,D的浓度为原平衡时的1.6倍,则( )
A.平衡向正反应方向移动
B.A的转化率变小
C.D体积分数变大
D.a>c+d
查看答案和解析>>
科目:
来源:2011-2012学年浙江省温州市高二(下)期中化学试卷(解析版)
题型:选择题
人体血液内的血红蛋白(Hb)易与O
2结合生成HbO
2,因此具有输氧能力,CO吸入肺中发生反应:CO+HbO
2?O
2+HbCO,37℃时,该反应的平衡常数K=220.HbCO的浓度达到HbO
2浓度的0.02倍,会使人智力受损.据此,下列结论错误的是( )
A.CO与HbO
2反应的平衡常数
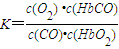
B.人体吸入的CO越多,与血红蛋白结合的O
2越少
C.当吸入的CO与O
2浓度之比大于或等于0.02时,人的智力才会受损
D.把CO中毒的病人放入高压氧仓中解毒,其原理是使上述平衡向左移动
查看答案和解析>>
科目:
来源:2011-2012学年浙江省温州市高二(下)期中化学试卷(解析版)
题型:选择题
在一密闭容器中加入A、B、C三种气体,保持一定温度,在t
1~t
4时刻测得各物质的浓度如下表.据此判断下列结论正确的是( )
| 测定时刻/s | t1 | t2 | t3 | t4 |
| c(A)/(mol/L) | 6 | 3 | 2 | 2 |
| c(B)/(mol/L) | 5 | 3.5 | 3 | 3 |
| c(C)/(mol/L) | 1 | 2.5 | 3 | 3 |
A.在t
3时刻反应已经停止
B.A的转化率比B的转化率低
C.在容器中发生的反应为:2A+B≒2C
D.在t
2~t
3内A的平均反应速率为:[

]mol/
查看答案和解析>>
科目:
来源:2011-2012学年浙江省温州市高二(下)期中化学试卷(解析版)
题型:选择题
镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用.已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH+2H
2O
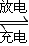
Cd(OH)
2+2Ni(OH)
2.有关该电池的说法正确的是( )
A.充电时阳极反应:Ni(OH)
2-e
-+OH
-═NiOOH+H
2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH
-向正极移动
查看答案和解析>>
科目:
来源:2011-2012学年浙江省温州市高二(下)期中化学试卷(解析版)
题型:填空题
(1)家用液化气的主要成分之一是丁烷(C4H10),当1kg丁烷完全燃烧生成二氧化碳和液态水时,放出热量为5×104kJ,试写出表示丁烷燃烧热的热化学方程式:
(2)已知:C(s)+O2(g)=CO2(g)△H=-393.5kJ?mol-1
2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ?mol-1
现有0.2mol的炭粉和氢气组成的悬浮气,且混合物在氧气中完全燃烧,共放出63.53kJ热量,则混合物中C与H2的物质的量之比为
(3)盖斯定律在生产和科学研究中有很重要的意义.有些反应的反应热虽然无法直接测得,但可通过间接的方法测定.现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=-24.8kJ?mol-1
3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H=-47.4kJ?mol-1
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=+640.5kJ?mol-1
写出CO(g)还原FeO(s)得到Fe(s)体和CO2(g)的热化学反应方程式: .
查看答案和解析>>
科目:
来源:2011-2012学年浙江省温州市高二(下)期中化学试卷(解析版)
题型:填空题
如图装置中,A、B两池溶液的体积均为200mL,
(1)判断装置的名称:A池为
B池为
(2)A池中左边石墨棒为
极,电极反应式为
A池中电池总反应式
(3)若工作一段时间后,B池中Cu棒上析出224ml气体(标准状态),则电路中通过了
mol电子,B池中溶液质量
(填“增加”、“不变”或“减少”)
g,若反应前后溶液的体积不变,反应后A池溶液的pH为
.

查看答案和解析>>
科目:
来源:2011-2012学年浙江省温州市高二(下)期中化学试卷(解析版)
题型:填空题
一定条件下,将SO
2和O
2充入一密闭容器中,发生如下反应:2SO
2(g)+O
2(g)
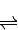
2SO
3(g),△H<0.反应过程中SO
2、O
2、SO
3物质的量变化如图所示:
回答下列问题:
(1)若降低温度,该反应的化学平衡常数
.(填“增大”“减小”或“不变”)
(2)该反应处于平衡状态的时间段为
.
(3)反应进行至20min时,曲线发生变化的原因是
(用文字表达).10min到15min的曲线变化的原因可能是
(填写编号).
a.加了催化剂 b.缩小容器体积
c.降低温度 d.增加SO
3的物质的量
(4)维持容器体积不变,向该反应的平衡体系中充入氮气,则平衡
( 填“向左”或“向右”或“不”)移动;维持容器体积不变,向该反应的平衡体系中移走部分混合气体,则平衡
( 填“向左”或“向右”或“不”) 移动.

查看答案和解析>>

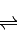 CO(g)+H2(g)△H>0达到平衡,下列叙述正确的是( )
CO(g)+H2(g)△H>0达到平衡,下列叙述正确的是( )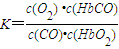
 ]mol/
]mol/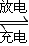 Cd(OH)2+2Ni(OH)2.有关该电池的说法正确的是( )
Cd(OH)2+2Ni(OH)2.有关该电池的说法正确的是( )
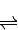 2SO3(g),△H<0.反应过程中SO2、O2、SO3物质的量变化如图所示:
2SO3(g),△H<0.反应过程中SO2、O2、SO3物质的量变化如图所示: