
科目: 来源:2012-2013学年湖北省四校高二(上)期末化学试卷(仙桃中学、麻城一中、新洲一中、武汉二中)(解析版) 题型:选择题
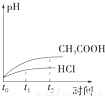



查看答案和解析>>
科目: 来源:2012-2013学年湖北省四校高二(上)期末化学试卷(仙桃中学、麻城一中、新洲一中、武汉二中)(解析版) 题型:选择题
| 操作 | 现象 | 结论 | |
| A | 用CH3COOH溶液浸泡水垢 | 水垢溶解,有无色气泡 | 碱性:NaHCO3>CH3COONa |
B | 测定等浓度的Na2CO3和Na2SO3溶液的pH | 前者pH比后者的大 | 非金属性:S>C |
| C | 向FeBr2溶液中通入过量Cl2 | 溶液由浅绿色变成黄色 | 氧化性:Br2>Fe3+ |
| D | 向盛有1mL 0.1mol?L-1 AgNO3溶液的试管中滴加2~4滴0.1mol?L-1 NaCl溶液,后继续滴加 0.1mol?L-1 KI溶液. | 出现黄色沉淀 | 溶解度:AgCl>AgI |
查看答案和解析>>
科目: 来源:2012-2013学年湖北省四校高二(上)期末化学试卷(仙桃中学、麻城一中、新洲一中、武汉二中)(解析版) 题型:选择题
查看答案和解析>>
科目: 来源:2012-2013学年湖北省四校高二(上)期末化学试卷(仙桃中学、麻城一中、新洲一中、武汉二中)(解析版) 题型:选择题

查看答案和解析>>
科目: 来源:2012-2013学年湖北省四校高二(上)期末化学试卷(仙桃中学、麻城一中、新洲一中、武汉二中)(解析版) 题型:选择题
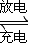 Na2S4+3NaBr.闭合开关K时,b极附近先变红色.下列说法正确的是( )
Na2S4+3NaBr.闭合开关K时,b极附近先变红色.下列说法正确的是( )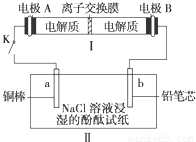
查看答案和解析>>
科目: 来源:2012-2013学年湖北省四校高二(上)期末化学试卷(仙桃中学、麻城一中、新洲一中、武汉二中)(解析版) 题型:选择题
查看答案和解析>>
科目: 来源:2012-2013学年湖北省四校高二(上)期末化学试卷(仙桃中学、麻城一中、新洲一中、武汉二中)(解析版) 题型:解答题

查看答案和解析>>
科目: 来源:2012-2013学年湖北省四校高二(上)期末化学试卷(仙桃中学、麻城一中、新洲一中、武汉二中)(解析版) 题型:解答题

查看答案和解析>>
科目: 来源:2012-2013学年湖北省四校高二(上)期末化学试卷(仙桃中学、麻城一中、新洲一中、武汉二中)(解析版) 题型:解答题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 8.1 | 11.6 | 10.3 | 11.1 | 11.3 |
查看答案和解析>>
科目: 来源:2012-2013学年湖北省四校高二(上)期末化学试卷(仙桃中学、麻城一中、新洲一中、武汉二中)(解析版) 题型:解答题
| 元素 | 相 关 信 息 |
| T | T原子所处的周期数、族序数分别与其原子序数相等 |
| X | X的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同 |
| Z | Z可形成Z2、Z3两种气态单质 |
| Q | 在该元素所在周期中,Q的基态原子的第一电离能最小 |
| R | R的离子为单核离子,且离子半径是与其具有相同电子层结构离子中半径最小的 |
| P | Z是P不同周期的邻族元素;R和P的原子序数之和为30 |
| W | W的一种核素的质量数为56,中子数为30 |
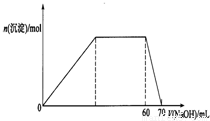
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com