
科目: 来源: 题型:解答题
 2O3
2O3查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:多选题
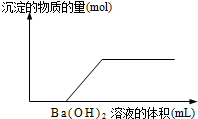 向由盐酸、碳酸钠、硫酸、氯化铜、氯化钠中的一种或几种混溶形成的稀溶液中,滴入氢氧化钡溶液,产生沉淀的量与加入氢氧化钡溶液体积的关系如图所示,则下列关于该溶液中溶质的判断正确的是
向由盐酸、碳酸钠、硫酸、氯化铜、氯化钠中的一种或几种混溶形成的稀溶液中,滴入氢氧化钡溶液,产生沉淀的量与加入氢氧化钡溶液体积的关系如图所示,则下列关于该溶液中溶质的判断正确的是查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
硅是重要的半导体材料,构成了现代电子工业的基础.请回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号为______,该能层具有的原子轨道数为______、电子数为______.
(2)硅主要以硅酸盐、______等化合物的形式存在于地壳中.
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以______相结合,其晶胞中共有8个原子,其中在面心位置贡献______个原子.
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备.工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为______.
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
| 化学键 | C-C | C-H | C-O | Si-Si | Si-H | Si-O |
| 键能/(kJ?mol-1) | 356 | 413 | 336 | 226 | 318 | 452 |
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是______.
②SiH4的稳定性小于CH4,更易生成氧化物,原因是______.
(6)在硅酸盐中,SiO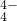 四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式.图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为______,Si与O的原子数之比为______,化学式为______.
四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式.图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为______,Si与O的原子数之比为______,化学式为______.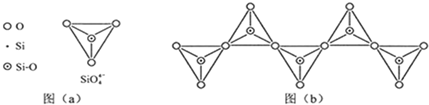
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:单选题
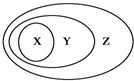 用如图表示的一些物质或概念间的从属关系中不正确的是
用如图表示的一些物质或概念间的从属关系中不正确的是| X | Y | Z | |
| 例 | 氧化物 | 化合物 | 纯净物 |
| A | 苯的同系物 | 芳香烃 | 芳香族化合物 |
| B | 胶体 | 分散系 | 混合物 |
| C | 电解质 | 离子化合物 | 化合物 |
| D | 碱性氧化物 | 金属氧化物 | 氧化物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com