
科目: 来源:2012-2013学年福建省厦门外国语学校高二(上)期中化学试卷(解析版) 题型:选择题
查看答案和解析>>
科目: 来源:2012-2013学年福建省厦门外国语学校高二(上)期中化学试卷(解析版) 题型:填空题
| 元素代号 | Ⅰ1 | Ⅰ2 | Ⅰ3 | Ⅰ4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
查看答案和解析>>
科目: 来源:2012-2013学年福建省厦门外国语学校高二(上)期中化学试卷(解析版) 题型:填空题
| 锂 | X | Y | |
| 失去第一个电子 | 519 | 502 | 589 |
| 失去第二个电子 | 7296 | 4570 | 1820 |
| 失去第三个电子 | 11799 | 6920 | 2750 |
| 失去第四个电子 | 9550 | 11600 |
查看答案和解析>>
科目: 来源:2012-2013学年福建省厦门外国语学校高二(上)期中化学试卷(解析版) 题型:填空题
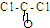 ,则COCl2分子内含有 .
,则COCl2分子内含有 .查看答案和解析>>
科目: 来源:2012-2013学年福建省厦门外国语学校高二(上)期中化学试卷(解析版) 题型:填空题
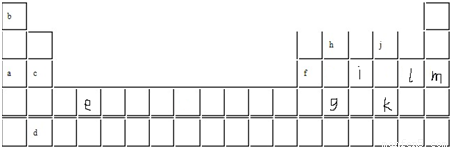
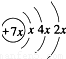 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:查看答案和解析>>
科目: 来源:2012-2013学年福建省厦门外国语学校高二(上)期中化学试卷(解析版) 题型:填空题
查看答案和解析>>
科目: 来源:2012-2013学年福建省厦门外国语学校高二(上)期中化学试卷(解析版) 题型:填空题
查看答案和解析>>
科目: 来源:2012-2013学年福建省厦门外国语学校高二(上)期中化学试卷(解析版) 题型:填空题
查看答案和解析>>
科目: 来源:2012-2013学年福建省厦门外国语学校高二(上)期中化学试卷(解析版) 题型:解答题
 B+D 在四个不同条件下进行.B、D起始为0.反应物A的浓度(mol/L)随反应时间(min)变化情况如下表:
B+D 在四个不同条件下进行.B、D起始为0.反应物A的浓度(mol/L)随反应时间(min)变化情况如下表:| 实验序号 | 10 | 20 | 30 | 40 | 50 | 60 | ||
| 1 | 800℃ | 1.0 | 0.8 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | C2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
查看答案和解析>>
科目: 来源:2012-2013学年江苏省扬大附中高一(上)期中化学试卷(解析版) 题型:选择题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com