
科目: 来源:2010-2011学年广东省广州市白云中学高三(上)第四次月考化学试卷(解析版) 题型:选择题
查看答案和解析>>
科目: 来源:2010-2011学年广东省广州市白云中学高三(上)第四次月考化学试卷(解析版) 题型:选择题
查看答案和解析>>
科目: 来源:2010-2011学年广东省广州市白云中学高三(上)第四次月考化学试卷(解析版) 题型:选择题

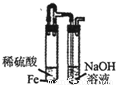
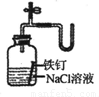
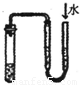
查看答案和解析>>
科目: 来源:2010-2011学年广东省广州市白云中学高三(上)第四次月考化学试卷(解析版) 题型:选择题
| 选项 | X | Y | Z | 甲 | 乙 |
| A | H2 | Si | Cl2 | SiCl4 | HCl |
| B | Mg | C | O2 | CO2 | MgO |
| C | Zn | Fe | Cl2 | FeCl2 | ZnCl2 |
| D | O2 | N2 | H2 | NH3 | H2O |
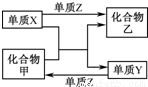
查看答案和解析>>
科目: 来源:2010-2011学年广东省广州市白云中学高三(上)第四次月考化学试卷(解析版) 题型:选择题
| 实验操作 | 实验现象 | 实验结论 | |
| A | 适量二氧化碳通入氯化钡溶液中 | 产生沉淀 | 碳酸的酸性比盐酸弱 |
B | 二氧化硫通入溴水中 | 溶液褪色 | 二氧化硫有漂白性 |
| C | 取少量某无色溶液,先滴加氯水,再加入少量四氯化碳,振荡、静置 | 溶液分层,下层呈橙红色 | 原无色溶液中一定有溴离子 |
D | 将铜片放入浓硝酸中 | 产生大量无色气体,溶液变为蓝绿色 | 只体现浓硝酸的强氧化性 |
查看答案和解析>>
科目: 来源:2010-2011学年广东省广州市白云中学高三(上)第四次月考化学试卷(解析版) 题型:选择题
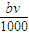 mol
mol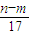 mol
mol L
L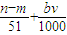 )mol
)mol查看答案和解析>>
科目: 来源:2010-2011学年广东省广州市白云中学高三(上)第四次月考化学试卷(解析版) 题型:解答题
 H2+I2
H2+I2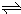 2HI(g)的平衡常数K=______.
2HI(g)的平衡常数K=______.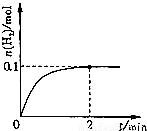
查看答案和解析>>
科目: 来源:2010-2011学年广东省广州市白云中学高三(上)第四次月考化学试卷(解析版) 题型:解答题
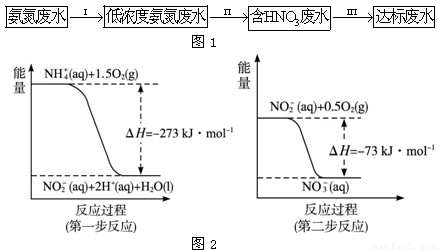
查看答案和解析>>
科目: 来源:2010-2011学年广东省广州市白云中学高三(上)第四次月考化学试卷(解析版) 题型:解答题
查看答案和解析>>
科目: 来源:2010-2011学年广东省广州市白云中学高三(上)第四次月考化学试卷(解析版) 题型:解答题
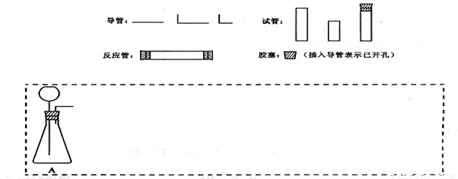
| 仪器符号 | 仪器中所加物质 | 作用 |
| A | 石灰石、稀盐酸 | 石灰石与盐酸生成CO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com