相关习题
0 64641 64649 64655 64659 64665 64667 64671 64677 64679 64685 64691 64695 64697 64701 64707 64709 64715 64719 64721 64725 64727 64731 64733 64735 64736 64737 64739 64740 64741 64743 64745 64749 64751 64755 64757 64761 64767 64769 64775 64779 64781 64785 64791 64797 64799 64805 64809 64811 64817 64821 64827 64835 203614
科目:
来源:2009-2010学年江苏省盐城市滨海中学高一(下)期中化学试卷(解析版)
题型:选择题
反应:CO(g)+H
2O (g)=CO
2(g)+H
2(g) 的能量变化如图所示,有关该反应的说法正确的是( )
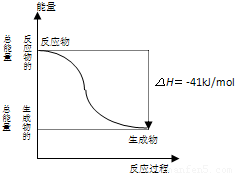
A.该反应为吸热反应
B.1molCO
2(g)和1molH
2(g)反应生成1molCO(g)和1molH
2O(g)要放出41kJ热量
C.反应的热化学方程式是:CO(g)+H
2O(g)=CO
2(g)+H
2(g)△H=+41kJ/mol
D.CO(g)与H
2O(g)所具有的总能量大于CO
2(g)与H
2(g)所具有的总能量
查看答案和解析>>
科目:
来源:2009-2010学年江苏省盐城市滨海中学高一(下)期中化学试卷(解析版)
题型:选择题
氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如右图.下列有关氢氧燃料电池的说法正确的是( )
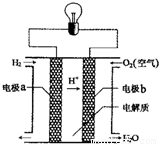
A.该电池工作时电能转化为化学能
B.该电池中电极a是正极
C.外电路中电子由电极b通过导线流向电极a
D.该电池的总反应:2H
2+O
2=2H
2O
查看答案和解析>>
科目:
来源:2009-2010学年江苏省盐城市滨海中学高一(下)期中化学试卷(解析版)
题型:选择题
下列叙述正确的是( )
A.离子化合物中不可能含有共价键
B.电解氯化铜溶液时,阴极电极反应式是2Cl--2e-=Cl2↑
C.由非金属元素组成的化合物不一定是共价化合物
D.熔融NaCl、MgO晶体时克服的作用力不同
查看答案和解析>>
科目:
来源:2009-2010学年江苏省盐城市滨海中学高一(下)期中化学试卷(解析版)
题型:填空题
(1)某种粒子有1个原子核,核中有17个质子,20个中子,核外有18个电子,该粒子的化学符号是 .
(2)某分子中有5个原子核,共有10个电子,这种分子的结构式是 .
(3)CaCl2是离子化合物,其电子式为: .
查看答案和解析>>
科目:
来源:2009-2010学年江苏省盐城市滨海中学高一(下)期中化学试卷(解析版)
题型:填空题
在一定温度下,在1L容器中m molSO2和n mol O2,反应达到平衡时有q molSO2发生了反应,试填写下列空白:
(1)达到平衡时,c(SO2)=
(2)平衡时气体总的物质的量为
(3)在其它条件不变时,压缩容器使压强增大该反应的速率会 ;或者减少SO2的量反应速率会 .
查看答案和解析>>
科目:
来源:2009-2010学年江苏省盐城市滨海中学高一(下)期中化学试卷(解析版)
题型:填空题
A、B、C、D、E、F是原子序数依次增大的六种常见元素.E的单质在C2中燃烧的产物可使品红溶液褪色.F和C元素形成的化合物F3C4具有磁性.A的单质在C2中燃烧可生成AC和AC2两种气体.D的单质是一种金属,该金属在AC2中剧烈燃烧生成黑、白两种固体.请回答下列问题:
(1)B的单质分子的结构式为 ;DC的化学式为 ;A元素在周期表中的位置是 .
(2)A元素形成的同素异形体的晶体类型可能是(填序号) .
①离子晶体 ②原子晶体 ③金属晶体 ④分子晶体
(3)A、B、C形成的10电子氢化物中,A、B、C的氢化物沸点最高的是(写化学式) ;B、C的氢化物分子结合H+能力较强的是(写化学式) ,用一个离子方程式加以证明 .
查看答案和解析>>
科目:
来源:2009-2010学年江苏省盐城市滨海中学高一(下)期中化学试卷(解析版)
题型:填空题
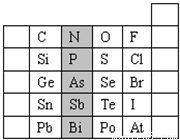
元素在周期表中的位置,反映了元素的原子结构和元素的性质.右图是元素周期表的一部分.
(1)阴影部分元素N的最高价氧化物为
.根据元素周期律,请你预测:H
3AsO
4、H
3PO
4的酸性强弱:H
3AsO
4 H
3PO
4.(用“>”、“<”或“=”表示)
(2)元素S的最高正价和最低负价分别为
、
,
(3)在一定条件下,S与H
2反应有一定限度(可理解为反应进行的程度),请判断在相同条件下Se与H
2反应的限度
(选填“更大”、“更小”或“相同”).
(4)羰基硫(COS)分子结构与二氧化碳分子结构相似,所有原子的最外层都满足8电子结构.请写出羰基硫分子的电子式
(5)单质砷和热的浓H
2SO
4反应,生成As
2O
3,反应的化学方程式为
.
查看答案和解析>>
科目:
来源:2009-2010学年江苏省盐城市滨海中学高一(下)期中化学试卷(解析版)
题型:填空题
为了用实验的方法验证镁和铁的金属性强弱,学生甲和学生乙分别设计了两种不同的方法:
方案一:学生甲用水作试剂,比较镁和铁与水反应的情况
方案二:学生乙用稀盐酸作试剂,比较镁和铁与稀盐酸反应的情况
回答下列问题:
(1)以上两实验方案实验现象较为明显的是方案
(2)学生乙在实验中取了一段镁条,投入稀盐酸中,现象不是十分明显,请分析原因 .
(3)学生丙另辟蹊径,仅用镁条、铁片与盐酸只进行一次实验也得出正确的结论(其它用品自选),学生丙用的是什么方法? 简述现象 .
查看答案和解析>>
科目:
来源:2009-2010学年江苏省盐城市滨海中学高一(下)期中化学试卷(解析版)
题型:填空题
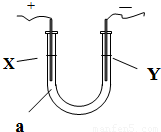
电解原理在化学工业中有广泛应用.如图所示,在U形管中加入NaCl溶液,在两极各滴入几滴石蕊试液,插入惰性电极,接通电源.
(1)①一段时间后可观察到的Y电极附近观察到的现象是
.
②X电极上的电极反应式为
,③请写出电解饱和NaCl溶液的化学方程式
.
(2)如果电解液a选用CuCl
2溶液,则在电解过程中被氧化的是:
在此变化过程中发生的能量转化的形式是
.
查看答案和解析>>
科目:
来源:2009-2010学年江苏省盐城市滨海中学高一(下)期中化学试卷(解析版)
题型:解答题
把0.4mol X气体和0.6mol Y气体混合于2L密闭容器中,使它们发生如下反应:4X(g)+5Y(g)=n Z(g)+6W(g).2min 末已生成0.3mol W,若测知以Z的浓度变化表示的反应速率为0.05mol?-1,计算:
(1)前2min内用X的浓度变化表示的平均反应速率;
(2)2min末时Y的浓度;
(3)化学反应方程式中n的值是多少?
查看答案和解析>>




