相关习题
0 65015 65023 65029 65033 65039 65041 65045 65051 65053 65059 65065 65069 65071 65075 65081 65083 65089 65093 65095 65099 65101 65105 65107 65109 65110 65111 65113 65114 65115 65117 65119 65123 65125 65129 65131 65135 65141 65143 65149 65153 65155 65159 65165 65171 65173 65179 65183 65185 65191 65195 65201 65209 203614
科目:
来源:2011-2012学年福建省泉州市南安一中高一(上)期中化学试卷(解析版)
题型:选择题
在铁的电化学腐蚀中,发生还原反应的那个电极上进行的电极反应是( )
A.2H2O+O2+4e-═4OH-
B.2H++2e-═H2
C.4OH--4e-═2H2O+O2
D.Fe-2e-═Fe2+
查看答案和解析>>
科目:
来源:2011-2012学年福建省泉州市南安一中高一(上)期中化学试卷(解析版)
题型:选择题
下列有关判断正确的是( )
A.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-=Cu2+
B.由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+3OH-=Al(OH)3
C.由Al、Cu、浓硝酸组成原电池,其负极反应式为:Cu-2e-=Cu2+
D.用原电池和电解池装置都能实现2HCl+Cu=CuCl2+H2↑反应
查看答案和解析>>
科目:
来源:2011-2012学年福建省泉州市南安一中高一(上)期中化学试卷(解析版)
题型:选择题
中和热测定实验中,用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH进行实验,下列说法不正确的是( )
A.改用60mL0.50mol/L盐酸跟50mL0.55mol/LNaOH溶液进行反应,求出的中和热数值和原来相同
B.用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH进行实验比用50mL0.50mol/L盐酸和50mL0.50mol/LNaOH测得的数值准确
C.酸碱混合时,量筒中NaOH溶液应缓缓倒入小烧杯中,不断用玻璃棒搅拌
D.装置中的大小烧杯之间填满碎泡沫塑料的作用是保温隔热、减少热量损失
查看答案和解析>>
科目:
来源:2011-2012学年福建省泉州市南安一中高一(上)期中化学试卷(解析版)
题型:选择题
镍镉电池在通讯、交通及日常生活中有着广泛的应用,其工作原理可以表示为:Cd+2NiO(OH)+2H
2O

2Ni(OH)
2+Cd(OH)
2以下说法中正确的是( )
A.以上反应是可逆反应
B.放电时,镉为正极
C.充电时电池上标有“+”号的电极连接电源负极
D.以镍镉电池为电源,电解Na
2CO
3溶液,当收集到气体的总体积为33.6L(标况下)时,电池中转移了2mol电子
查看答案和解析>>
科目:
来源:2011-2012学年福建省泉州市南安一中高一(上)期中化学试卷(解析版)
题型:填空题
下列各情况,在其中Fe片腐蚀由快到慢的顺序是
.
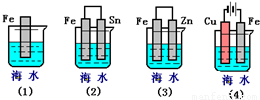
查看答案和解析>>
科目:
来源:2011-2012学年福建省泉州市南安一中高一(上)期中化学试卷(解析版)
题型:填空题
将煤转化为水煤气(CO和H2的混合气体)是通过化学方法将煤转化为洁净燃料的方法之一.煤转化为水煤气的主要化学反应为:C(s)+H2O(g)=CO(g)+H2(g);△H1. 已知:
①2H2(g)+O2(g)=2H2O(g);△H2=-483.6kJ?mol-1
②2C(s)+O2(g)=2CO(g);△H3=-221.0kJ?mol-1
结合上述热化学方程式,计算得出△H1= .
查看答案和解析>>
科目:
来源:2011-2012学年福建省泉州市南安一中高一(上)期中化学试卷(解析版)
题型:填空题
对于下列反应:2SO
2+O
2 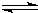
2SO
3,如果2min内SO
2的浓度由6mol/L下降为2mol/L,那么,用SO
2浓度变化来表示的化学反应速率为
,用O
2浓度变化来表示的反应速率为
.如果开始时SO
2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O
2)为0.5mol/,那么2min时SO
2的浓度为
.
查看答案和解析>>
科目:
来源:2011-2012学年福建省泉州市南安一中高一(上)期中化学试卷(解析版)
题型:填空题
2SO
2(g)+O
2(g)
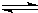
2SO
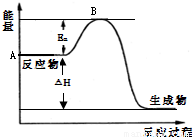
3(g)△H=a kJ?mol
-1,反应过程的能量变化如图所示.已知1mol SO
2(g)完全转化为1mol SO
3(g)放热99kJ.请回答:
(1)图中A点表示
,a=
.
(2)E
a的大小对该反应的△H
(填“有”或“无”)影响.该反应常用V
2O
5作催化剂,加入V
2O
5会使图中B点
(填“升高”、“降低”或“不变”).
(3)已知单质硫的燃烧热为296kJ?mol
-1,写出反应的热化学方程式:
,常温常压下,由单质硫和氧气经两步反应,生成3mol SO
3(g),放出的总热量为
_.
查看答案和解析>>
科目:
来源:2011-2012学年福建省泉州市南安一中高一(上)期中化学试卷(解析版)
题型:填空题
电解原理在化学工业中有广泛应用.右图表示一个电解池,其中a为电解质溶液,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
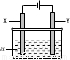
(1)X的电极名称是
(填写“阳极”或“阴极”).
(2)若要用该装置电解精炼粗铜,电解液a选用CuSO
4溶液,则X电极的材料是
,Y电极的材料是
.
(3)若X、Y都是惰性电极,a是饱和食盐水,实验开始时,同时在两边各滴入几滴酚酞试液,一段时间后,在X极附近观察到的现象是
,Y极上的电极反应式为
.
(4)若要用电镀方法在铁表面镀一层金属银,应该选择的方案是
.
| 方案 | X | Y | a溶液 |
| A | 银 | 石墨 | AgNO3 |
| B | 银 | 铁 | AgNO3 |
| C | 铁 | 银 | Fe(NO3)3 |
| D | 铁 | 银 | AgNO3 |
查看答案和解析>>
科目:
来源:2011-2012学年福建省泉州市南安一中高一(上)期中化学试卷(解析版)
题型:填空题
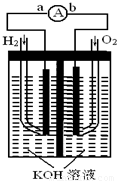
氢氧燃料电池是符合绿色化学理念的新型发电装置.
如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
(1)氢氧燃料电池的能量转化主要形式是
,在导线中电子流动方向为
(用a、b 表示).
(2)负极反应式为
.
(3)电极表面镀铂粉的原因
.
(4)该电池工作时,H
2和O
2连续由外部供给,电池可连续
不断提供电能.因此,大量安全储氢是关键技术之一.金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H
2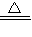
2LiH
Ⅱ.LiH+H
2O═LiOH+H
2↑
①反应Ⅰ中的还原剂是
,反应Ⅱ中的氧化剂是
.
②已知LiH固体密度约为0.8g/cm
3.用锂吸收224L(标准状况)H
2,生成的LiH体积与被吸收的H
2体积比为
.
③由②生成的LiH与H
2O作用,放出的H
2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为
mol.
查看答案和解析>>

 2Ni(OH)2+Cd(OH)2以下说法中正确的是( )
2Ni(OH)2+Cd(OH)2以下说法中正确的是( ) 2SO3,如果2min内SO2的浓度由6mol/L下降为2mol/L,那么,用SO2浓度变化来表示的化学反应速率为 ,用O2浓度变化来表示的反应速率为 .如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/,那么2min时SO2的浓度为 .
2SO3,如果2min内SO2的浓度由6mol/L下降为2mol/L,那么,用SO2浓度变化来表示的化学反应速率为 ,用O2浓度变化来表示的反应速率为 .如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/,那么2min时SO2的浓度为 . 2SO3(g)△H=a kJ?mol-1,反应过程的能量变化如图所示.已知1mol SO2(g)完全转化为1mol SO3(g)放热99kJ.请回答:
2SO3(g)△H=a kJ?mol-1,反应过程的能量变化如图所示.已知1mol SO2(g)完全转化为1mol SO3(g)放热99kJ.请回答:

 2LiH
2LiH