
科目: 来源:2011-2012学年江苏省南通市如皋市高三(上)期中化学试卷(解析版) 题型:选择题
查看答案和解析>>
科目: 来源:2011-2012学年江苏省南通市如皋市高三(上)期中化学试卷(解析版) 题型:选择题
查看答案和解析>>
科目: 来源:2011-2012学年江苏省南通市如皋市高三(上)期中化学试卷(解析版) 题型:选择题
 Cd(OH)2+2Ni(OH)2有关该电池的说法正确的是( )
Cd(OH)2+2Ni(OH)2有关该电池的说法正确的是( )查看答案和解析>>
科目: 来源:2011-2012学年江苏省南通市如皋市高三(上)期中化学试卷(解析版) 题型:选择题

查看答案和解析>>
科目: 来源:2011-2012学年江苏省南通市如皋市高三(上)期中化学试卷(解析版) 题型:填空题

| Fe3+ | Cu2+ | Fe2+ | |
| 开始沉淀的pH | 2.7 | 5.4 | 8.1 |
| 沉淀完全的pH | 3.7 | 6.9 | 9.6 |
查看答案和解析>>
科目: 来源:2011-2012学年江苏省南通市如皋市高三(上)期中化学试卷(解析版) 题型:填空题
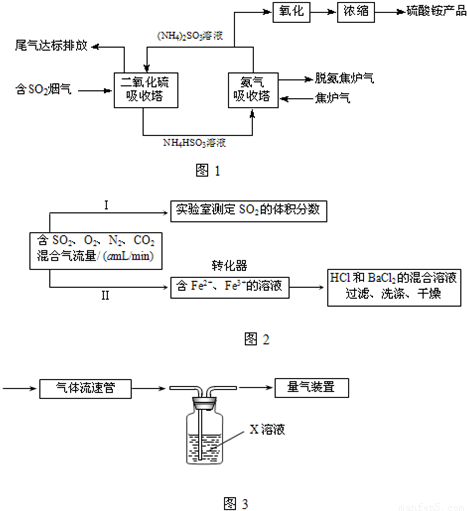
查看答案和解析>>
科目: 来源:2011-2012学年江苏省南通市如皋市高三(上)期中化学试卷(解析版) 题型:填空题
| T/K | T1 | 573 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
 ,此时N2的转化率为 .
,此时N2的转化率为 .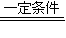 4NO+6H2O 4NO+3O2+2H2O=4HNO3
4NO+6H2O 4NO+3O2+2H2O=4HNO3查看答案和解析>>
科目: 来源:2011-2012学年江苏省南通市如皋市高三(上)期中化学试卷(解析版) 题型:填空题

查看答案和解析>>
科目: 来源:2011-2012学年江苏省南通市如皋市高三(上)期中化学试卷(解析版) 题型:填空题
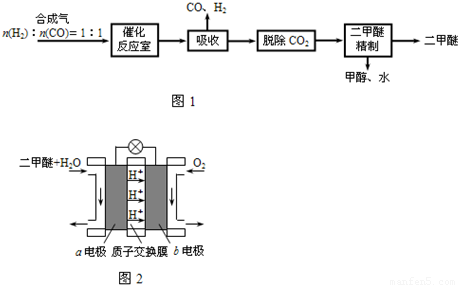
查看答案和解析>>
科目: 来源:2011-2012学年江苏省南通市如皋市高三(上)期中化学试卷(解析版) 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com