
科目: 来源:2012-2013学年河南省周口市郸城一中高二(上)强化训练化学试卷(二)(解析版) 题型:选择题
 增大
增大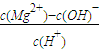 不变
不变查看答案和解析>>
科目: 来源:2012-2013学年河南省周口市郸城一中高二(上)强化训练化学试卷(二)(解析版) 题型:选择题
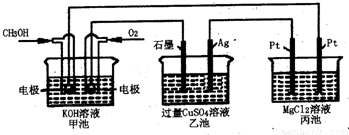
查看答案和解析>>
科目: 来源:2012-2013学年河南省周口市郸城一中高二(上)强化训练化学试卷(二)(解析版) 题型:选择题
查看答案和解析>>
科目: 来源:2012-2013学年河南省周口市郸城一中高二(上)强化训练化学试卷(二)(解析版) 题型:选择题
| t/s | 50 | 150 | 250 | 350 | |
| n(PCl3)/mol | 0.32 | 0.38 | 0.40 | 0.40 |
查看答案和解析>>
科目: 来源:2012-2013学年河南省周口市郸城一中高二(上)强化训练化学试卷(二)(解析版) 题型:填空题
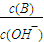 ; ②
; ②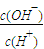 ;
;
查看答案和解析>>
科目: 来源:2012-2013学年河南省周口市郸城一中高二(上)强化训练化学试卷(二)(解析版) 题型:解答题
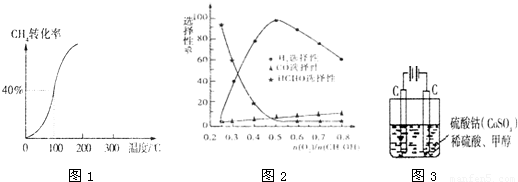
 ,其他条件不变,对平衡体系产生的影响是______(填字母序号).
,其他条件不变,对平衡体系产生的影响是______(填字母序号). 减小 E.平衡常数K增大
减小 E.平衡常数K增大查看答案和解析>>
科目: 来源:2012-2013学年河南省周口市郸城一中高二(上)强化训练化学试卷(二)(解析版) 题型:解答题
| 物质 | FeS | MnS | CuS | PbS | HgS | ZnS |
| Ksp | 6.3×10-18 | 2.5×10-13 | 1.3×10-35 | 3.4×10-28 | 6.4×10-33 | 1.6×10-24 |

查看答案和解析>>
科目: 来源:2012-2013学年河南省周口市郸城一中高二(上)强化训练化学试卷(二)(解析版) 题型:解答题
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |

查看答案和解析>>
科目: 来源:2012-2013学年北京市海淀区进修学校高一(上)期中化学试卷(解析版) 题型:选择题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com