
科目: 来源:2012-2013学年黑龙江省哈尔滨六中高三(上)期中化学试卷(解析版) 题型:选择题
查看答案和解析>>
科目: 来源:2012-2013学年黑龙江省哈尔滨六中高三(上)期中化学试卷(解析版) 题型:选择题

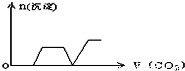
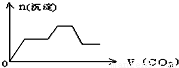

查看答案和解析>>
科目: 来源:2012-2013学年黑龙江省哈尔滨六中高三(上)期中化学试卷(解析版) 题型:选择题
查看答案和解析>>
科目: 来源:2012-2013学年黑龙江省哈尔滨六中高三(上)期中化学试卷(解析版) 题型:选择题
查看答案和解析>>
科目: 来源:2012-2013学年黑龙江省哈尔滨六中高三(上)期中化学试卷(解析版) 题型:解答题
 ,A、B、D、E这四种元素,每一种与C元素都能形成元素的原子个数比不相同的多种化合物.请回答下列问题:
,A、B、D、E这四种元素,每一种与C元素都能形成元素的原子个数比不相同的多种化合物.请回答下列问题:查看答案和解析>>
科目: 来源:2012-2013学年黑龙江省哈尔滨六中高三(上)期中化学试卷(解析版) 题型:解答题
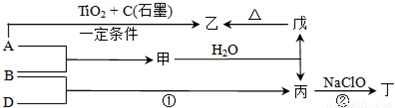
查看答案和解析>>
科目: 来源:2012-2013学年黑龙江省哈尔滨六中高三(上)期中化学试卷(解析版) 题型:解答题

查看答案和解析>>
科目: 来源:2012-2013学年黑龙江省哈尔滨六中高三(上)期中化学试卷(解析版) 题型:解答题
 Fe(OH)2+Ni(OH)2;高铁酸酸钠(Na2FeO4)是一种新型净水剂.用下面装置可以制取少量高铁酸钠.
Fe(OH)2+Ni(OH)2;高铁酸酸钠(Na2FeO4)是一种新型净水剂.用下面装置可以制取少量高铁酸钠.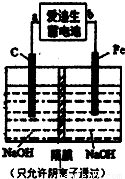
查看答案和解析>>
科目: 来源:《第1章 物质结构元素周期律》2011年单元测试卷(胜泉中学)(解析版) 题型:选择题
查看答案和解析>>
科目: 来源:《第1章 物质结构元素周期律》2011年单元测试卷(胜泉中学)(解析版) 题型:选择题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com