
科目: 来源:2012-2013学年上海市青浦区高三上学期期末教学质量调研化学试卷(解析版) 题型:选择题
常温下,取0.3 mol/L HY溶液与0.3 mol/L NaOH溶液等体积混合(不计混合后溶液体积变化),测得混合溶液的pH=9,则下列说法(或关系式)正确的是
A.混合溶液中由水电离出来的c(OH-)=1×10-9 mol/L
B.混合溶液中离子浓度大小次序为:c(Y-)>c(Na+)>c(OH-)>c(H+)
C.c(OH-)=c(HY)=c(H+)=1×10-9 mol/L
D.c(Na+)=c(Y-)+c(HY)=0.3 mol/L
查看答案和解析>>
科目: 来源:2012-2013学年上海市青浦区高三上学期期末教学质量调研化学试卷(解析版) 题型:选择题
某结晶水合物的化学式为R•nH2O,其相对分子质量为M。25℃时,将a g该晶体溶于b g H2O中恰好形成V mL饱和溶液。下列表达式正确的是
A.饱和溶液物质的量浓度为: 1000 a(M -18n) mol/L
1000 a(M -18n) mol/L
B.饱和溶液溶质的质量分数为:
C.25℃时R的溶解度为: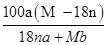 g/100 g H2O
g/100 g H2O
D.饱和溶液的密度为: g/mL
g/mL
查看答案和解析>>
科目: 来源:2012-2013学年上海市青浦区高三上学期期末教学质量调研化学试卷(解析版) 题型:填空题
现有A、B、C、D四种短周期元素,它们的相关结构和性质信息如下表所示,请结合相关信息,完成相关的问题:
元素 相关结构和性质
A 其单质的一种晶体不是金属晶体,但是电的良导体,且难熔、质软并有润滑性,可用作原子核反应堆的慢化剂、火箭发动机喷灌和电极材料等。
B 其单质既能与强酸溶液反应,又能与强碱溶液反应,其简单离子在第三周期单核离子中半径最小。
C 是蛋白质的组成元素之一,原子核外有三种不同能量的电子,且未成对电子数最多。
D 原子核外最外层电子排布式为nsnnp2n+1
(1)表中所述A的单质晶体中微粒间的相互作用有_____________、_____________。
(2)B元素的氧化物所对应的晶体属于____晶体(填“分子”、“原子”、“离子”、“金属”),工业上制备B元素单质的化学方程式:_______________________。
(3)钠与C元素形成的Na3C晶体中,C元素以C3-存在,C3-的电子排布式为_____________。C元素的气态氢化物溶于水后溶液呈碱性的原因(用方程式表示)_____________(填序号)。
(4)与D同主族的短周期元素,其单质及其化合物与D的单质及化合物均具有的性质为____ (填序号)。
A.常温下单质跟水剧烈反应并放出氧气 B.气态氮化物具有很强的热稳定性
C.气态氢化物极易溶于水并呈强酸性 D.在HXO中X的化合价均为+l价
查看答案和解析>>
科目: 来源:2012-2013学年上海市青浦区高三上学期期末教学质量调研化学试卷(解析版) 题型:填空题
某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)己知KBrO3在反应中得到电子,则该反应的还原剂是_____________。
(2)已知0.2mol KBrO3在反应中得到1 mol电子生成X,则X的化学式为_____________。
(3)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,井标出电子转移的方向和数目:
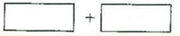
(4)溶液的酸碱性对氧化还原反应的方向有密切的关系。对于反应:AsO33-+I2+2OH- AsO43-+2I-+
2H2O,在较强酸性时,上述氧化还原反应向____进行(填:“正反应”或“逆反应”);强碱性时,是否有利H3As3还原I2?为什么?_______________________________________。
AsO43-+2I-+
2H2O,在较强酸性时,上述氧化还原反应向____进行(填:“正反应”或“逆反应”);强碱性时,是否有利H3As3还原I2?为什么?_______________________________________。
查看答案和解析>>
科目: 来源:2012-2013学年上海市青浦区高三上学期期末教学质量调研化学试卷(解析版) 题型:填空题
科学家一直致力于“人工固氨”的新方法研究。目前合成氨技术原理为:N2(g) +3H2(g)  2NH3(g)+92.4 kJ/mol673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如右图所示。
2NH3(g)+92.4 kJ/mol673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如右图所示。

(1)下列叙述正确的是
A.点a的正反应速率比点b的大
B.点c处反应达到平衡
C.点d和点e处的n (N2)相同
D.773K,30MPa 下,反应至t2时刻达到平衡,则n(NH3)比图中e点的值大
(2)在容积为2.0 L恒容得密闭容器中充入0.80 mol N2(g)和1.60 mol H2(g),673K、30MPa下达到平衡时,NH3的体积分数为20%。该条件下,N2(g)+3H2(g)  2NH3(g)的平衡常数值为:___。
2NH3(g)的平衡常数值为:___。
(3)K值越大,表明反应达到平衡时( )。
A. H2的转化率一定越高 B.NH3的产量一定越大
C.正反应进行得越完全 D.化学反应速率越大
(4)1998年希腊亚里斯多德大学的两位科学家采用高质子导电性的SCY陶瓷(能传递H+),实现了高温、常压下高转化率的电解合成氨。其实验装置如图。阳极的电极反应为:H2-2e→2H+,则阴极的电极反应为:_____________。

查看答案和解析>>
科目: 来源:2012-2013学年上海市青浦区高三上学期期末教学质量调研化学试卷(解析版) 题型:实验题
三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校化学实验小组通过实验探究某红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下:
查阅资料:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4。
设计探究实验:取少量粉末放入足量稀硫酸中,在所得溶液中滴加KSCN试剂。
(1)若只有Fe2O3,则实验现象是_____________。
(2)若固体粉末完全溶解无固体存在,滴加KSCN试剂时溶液不变红色,则此过程中的离子反应为:
____________________________。
(3)经实验分析,确定红色粉末为Cu2O和Fe2O3的混合物。实验小组欲测定Cu2O的质量分数。已知Cu2O在空气中加热生成CuO。
测定流程:

实验中操作A的名称为_____________。
灼烧过程中,所需仪器有:酒精灯、玻璃棒、_____________等(夹持仪器除外)。
(4)写出混合物中Cu2O的质量分数的表达式_____________。
实验小组欲利用红色粉末制取较纯净的胆矾(CuSO4•5H2O)。经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下:

实验室有下列试剂可供选择:A.氯水 B.H2O2 C.NaOH D.Cu2(OH)2CO3
实验小组设计如下实验方案制取胆矾:

(5)用试剂编号表示:试剂l为_____________,试剂2为_____________。
(6)为什么先“氧化”后“调节pH”?pH控制范围为多少?__________________________________
查看答案和解析>>
科目: 来源:2012-2013学年上海市青浦区高三上学期期末教学质量调研化学试卷(解析版) 题型:实验题
某兴趣小组挤究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示:

(1)SO2气体还原Fe3+反应的产物是_____________、_____________(填离子符号)。
(2)下列实验方案可以用于在实验室制取所需SO2的是____。
A.Na2SO3溶液与HNO3 B.Na2SO3固体与浓硫酸
C.固体硫在纯氧中燃烧 D.铜与热浓H2SO4
(3)装置C的作用是_____________。
(4)如果有280 mL SO2气体(已折算为标态)进入C装置中,则C中50 mL NaOH溶液的浓度至少为_____________mol/L才能达到目的。
(5)在上述装置中通入过量的SO2为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去。
方案②:往第一份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
方案③:往第二份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是____,原因是_______________________________________。
(6)能表明I-的还原性弱于SO2的现象是_________________________________________,写出有关离子方程式:_______________________________________。
查看答案和解析>>
科目: 来源:2012-2013学年上海市青浦区高三上学期期末教学质量调研化学试卷(解析版) 题型:填空题
工业上用甲苯生产对羟基苯甲酸乙酯( ),(俗称尼泊金乙酯)可用作防腐剂,对霉菌有很强的抑制作用。其过程如下:
),(俗称尼泊金乙酯)可用作防腐剂,对霉菌有很强的抑制作用。其过程如下:

据上图填写下列空白:
(1)有机物A的结构简式_____________,B的结构简式_____________;
(2)反应④属于_____________,反应⑤属于_____________。
(3)③和⑥的目的是_______________________________________;
(4)写出反应⑥的方程式_______________________________________。
查看答案和解析>>
科目: 来源:2012-2013学年上海市青浦区高三上学期期末教学质量调研化学试卷(解析版) 题型:填空题
煤的“气化”是使煤变成清洁能源的有效途径之一,其主要反应为:C+H2O CO↑+H2↑。甲酸苯丙酯(F)是生产香料和药物的主要原料。下图是用煤为原料合成甲酸苯丙酯的路线图(部分反应条件和生成物已略去)其中D的分子式为C9H10O,且能发生银镜反应。
CO↑+H2↑。甲酸苯丙酯(F)是生产香料和药物的主要原料。下图是用煤为原料合成甲酸苯丙酯的路线图(部分反应条件和生成物已略去)其中D的分子式为C9H10O,且能发生银镜反应。

根据上述转化关系回答下列问题:
(1)写出A、D的结构简式:A:________________________ D:__________________________
(2)D→E的反应类型为_____________,B中的官能团是_____________。
(3)写山检验B中的官能团的试剂及出现的现象。
试剂_____________,现象_______________________________________。
(4)写出C与E反应生成F的化学方程式_______________________________________。
(5)“合成气”( CO、H2)除作合成有机物的原料外,还有其它用途,如_____________(举两例)。
(6)F有多种同分异构体,写出满足下列条件的两种同分异构体的结构简式。
①属于酯类,且能发生银镜反应。 ②苯环上的一氯取代物只有两种结构。
③分子结构中只有两个甲基。______________________________、______________________________
查看答案和解析>>
科目: 来源:2012-2013学年上海市青浦区高三上学期期末教学质量调研化学试卷(解析版) 题型:计算题
(1)氨气在工农业有着广泛的用途。已知25%氨水的密度为0.91 g/cm3,5%氨水的密度为0.98 g/cm3。
①配制100mL 2.5mol/L氨水需要浓度为25%氨水______mL(保留2位小数)。
②若将上述两溶液等体积混合,所得氨水溶液的质量分数是_____________。
A.等于15% B.大于15% C.小于15% D.无法估算
已知:4NH3+O2 4NO+6 H2O,4NO+3O2+2H2O
4NO+6 H2O,4NO+3O2+2H2O 4HNO3
4HNO3
(2)设空气中氧气的体积分数为0.20,氮气的体积分数为0.80。
①a mol NO完全转化为HNO3理论上需要氧气_____________mol。
②为使NH3恰好完全氧化为NO,氨-空气混合气体中氨的体积分数(用小数表示)为_____________
(保留2位小数)。
(3)20.0 mol NH3用空气氧化,产生混合物的组成为:NO 18.0 mol、O2 12.0 mol、N2 150.0 mol和一定量硝酸,以及其他成分(高温下NO与O2不化合)。计算氨转化为NO和HNO3的转化率。
(4)20.0 mol NH3和一定量空气充分反应后,再转化为硝酸。通过计算,在图中画出HNO3的物质的量n(A)和空气的物质的量n (B)关系的理论曲线。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com