
科目: 来源:2014届云南省高二第二次月考(6月)化学试卷(解析版) 题型:选择题
乙酸乙酯能在多种条件下发生水解反应:CH3COOC2H5+H2O CH3COOH+C2H5OH已知该反应的速率随c(H+)的增大而加快。图为CH3COOC2H5的水解速率随时间的变化图。下列说法中正确的是( )
CH3COOH+C2H5OH已知该反应的速率随c(H+)的增大而加快。图为CH3COOC2H5的水解速率随时间的变化图。下列说法中正确的是( )
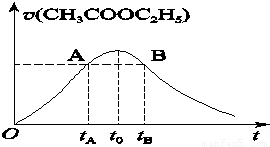
A.反应初期水解速率增大可能是溶液中c(H+)逐渐增大所致
B.A、B两点表示的c(CH3COOC2H5)相等
C.图中t0时反应达到平衡状态
D.tB时CH3COOC2H5的转化率低于tA时CH3COOC2H5的转化率
查看答案和解析>>
科目: 来源:2014届云南省高二第二次月考(6月)化学试卷(解析版) 题型:选择题
现有0.4 mol·L-1HA溶液和0.2 mol·L-1NaOH溶液等体积混合组成溶液。下列有关推断正确的是( )
A.若该溶液中HA电离能力大于A-水解能力,则有c(Na+)>c(A-)>c(HA)>c(H+)>c(OH-)
B.若该溶液中A-水解能力大于HA电离能力,则有c(A-)>c(HA)>(Na+)>c(OH-)>c(H+)
C.无论该溶液呈酸性还是碱性,都有c(Na+)+c(H+)=c(A-)+c(OH-)
D.无论该溶液呈酸性还是碱性,都有c(Na+)=c(A-)+c(HA)
查看答案和解析>>
科目: 来源:2014届云南省高二第二次月考(6月)化学试卷(解析版) 题型:选择题
研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl。下列“水” 电池在海水中放电时的有关说法正确的是( )
A.正极反应式:Ag+Cl--e-=AgCl
B.每生成1 mol Na2Mn5O10转移2 mol电子
C.Na+不断向“水”电池的负极移动
D.AgCl是还原产物
查看答案和解析>>
科目: 来源:2014届云南省高二第二次月考(6月)化学试卷(解析版) 题型:选择题
T ℃时在2 L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图(1)所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积分数与时间的关系如图(2)所示。则下列结论正确的是( )

A.反应进行的前3 min内,用X表示的反应速率v(X)=0.3 mol·(L·min)-1
B.容器中发生的反应可表示为:3X(g)+Y(g)  2Z(g)
2Z(g)
C.保持其他条件不变,升高温度,反应的化学平衡常数K减小
D.若改变反应条件,使反应进程如图(3)所示,则改变的条件是增大压强
查看答案和解析>>
科目: 来源:2014届云南省高二第二次月考(6月)化学试卷(解析版) 题型:填空题
现有A、B、C、D、E、F六种化合物,已知它们的阳离子有K+ 、Ag+ 、Ca2+ 、Ba2+、 Fe2+、 Al3+,阴离子有Cl-、 OH- 、CH3COO-、NO3- 、SO42- 、CO32-,现将它们分别配成0.1mol·L-1的溶液,进行如下实验:
①测得溶液A、C、E呈碱性,且碱性为A>E>C;
②向B溶液中滴加稀氨水,先出现沉淀,继续滴加氨水,沉淀消失;
③向D溶液中滴加Ba(NO3)2溶液,无明显现象;
④向F溶液中滴加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红褐色。 请根据上述实验现象,写出下列六种化合物的化学式:
A ,B________,C ,D ,E ,F 。
查看答案和解析>>
科目: 来源:2014届云南省高二第二次月考(6月)化学试卷(解析版) 题型:填空题
黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其燃烧产物为SO2和Fe2O3。
(1)已知1g FeS2完全燃烧放出7.1kJ热量,则表示FeS2完全燃烧反应的热化学方程式为:
______________________________________________________________。
(2)将0.050molSO2(g)和0.030molO2(g)放入容积为1L的密闭容器中,反应:2SO2(g)+O2(g) 2SO3(g)
在一定条件下达到平衡,测得c(SO3)=0.040mol/L。则该条件下反应的平衡常数K的数值为___________,SO2的平衡转化率为__________。
2SO3(g)
在一定条件下达到平衡,测得c(SO3)=0.040mol/L。则该条件下反应的平衡常数K的数值为___________,SO2的平衡转化率为__________。
(3)当该反应处于平衡状态时,欲使平衡向正反应方向移动且反应速率加快,下列措施可行的是 。(填字母)
A.向平衡混合物中充入Ar B.向平衡混合物中充入O2
C.改变反应的催化剂 D.降低反应的温度
(4)反应:2SO2(g)+O2(g) 2SO3(g)
△H<0 , SO2的转化率在起始温度T1=673K下随反应时间(t)的变化如下图,其他条件不变,仅改变起始温度为T2=723K,请在图中画出温度T2下SO2的转化率随反应时间变化的预期结果示意图。
2SO3(g)
△H<0 , SO2的转化率在起始温度T1=673K下随反应时间(t)的变化如下图,其他条件不变,仅改变起始温度为T2=723K,请在图中画出温度T2下SO2的转化率随反应时间变化的预期结果示意图。

查看答案和解析>>
科目: 来源:2014届云南省高二第二次月考(6月)化学试卷(解析版) 题型:填空题
化合物M是一种治疗心脏病药物的中间体,以A为原料的工业合成路线如下图所示。

已知:RONa+ R’X→ROR’+ NaX
根据题意完成下列填空:
(1)写出反应类型。反应① 反应②
(2)写出结构简式。A C
(3)写出 的邻位异构体分子内脱水产物香豆素的结构简式
。
的邻位异构体分子内脱水产物香豆素的结构简式
。
(4)由C生成D的另一个反应物是 ,反应条件是 。
(5)写出由D生成M的化学反应方程式 。
(6)A也是制备环己醇( )的原料,写出检验A已完全转化为环己醇的方法。
)的原料,写出检验A已完全转化为环己醇的方法。
_______________________________________________________________________。
查看答案和解析>>
科目: 来源:2014届云南省高二第二次月考(6月)化学试卷(解析版) 题型:填空题
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法。该法的工艺流程为CrO42- Cr2O72-
Cr2O72- Cr3+
Cr3+ Cr(OH)3↓
Cr(OH)3↓
其中第①步存在平衡:2CrO42-
(黄色)+2H+ Cr2O72-
(橙色)+H2O
Cr2O72-
(橙色)+H2O
(1)若平衡体系的pH=2,该溶液显________色。
(2)能说明第①步反应达平衡状态的是__________。
a.Cr2O72-和CrO42-的浓度相同
b.2v(Cr2O72-)=v(CrO42-)
c.溶液的颜色不变
(3)第②步中,还原1 mol Cr2O72-离子,需要________mol的FeSO4·7H2O。
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)
 Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至_______。
Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至_______。
方法2:电解法。该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(5)用Fe做电极的原因为__________________。
(6)在阴极附近溶液pH升高的原因是(用电极反应解释)_________________________________。溶液中同时生成的沉淀还有__________。
查看答案和解析>>
科目: 来源:2014届吉林省白山市高二下学期期末考试化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.在电解池的阴极和原电池的负极上都发生氧化反应
B.镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀
C.用惰性电极电解KOH溶液,阴、阳两极产物的物质的量之比为1:2
D.用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 molNaOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com