
科目: 来源:2012-2013学年黑龙江省高三上学期开学考试化学试卷(解析版) 题型:选择题
下列有关金属的工业制法中,正确的是:
A.制钠:用海水为原料制得精盐,再电解纯净的NaCl溶液
B.制铁:以铁矿石为原料,CO还原得铁
C.制镁:用海水为原料,经一系列过程制得氧化镁固体,H2还原得镁
D.制铝:从铝土矿中获得氧化铝再得到氯化铝固体,电解熔融的氯化铝得到铝
查看答案和解析>>
科目: 来源:2012-2013学年黑龙江省高三上学期开学考试化学试卷(解析版) 题型:选择题
向10mL 0.1mol·L-1NH4Al(SO4)2溶液中,滴加等浓度Ba(OH)2溶液x mL,下列叙述正确的是:
A.x=10时,溶液中有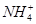 、
、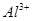 、
、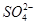 ,且
,且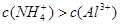
B.x=10时,溶液中有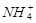 、
、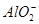 、
、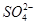 ,且
,且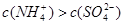
C.x=30时,溶液中有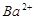 、
、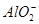 、
、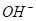 ,且
,且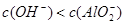
D.x=30时,溶液中有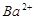 、
、 、
、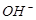 ,且
,且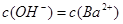
查看答案和解析>>
科目: 来源:2012-2013学年黑龙江省高三上学期开学考试化学试卷(解析版) 题型:选择题
下列表格中的各种情况,可以用下图的曲线表示的是
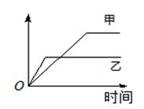
|
|
反 应 |
纵坐标 |
甲 |
乙 |
|
A |
相同质量的氨,在同一容器中 2NH3 |
氨气的转化率 |
500℃ |
400℃ |
|
B |
等质量钾、钠分别与足量水反应 |
H2质量 |
钠 |
钾 |
|
C |
在体积可变的恒压容器中,体积比1︰3的N2、H2, N2 + 3H2 |
氨气的浓度 |
活性高的催化剂 |
活性一般的催化剂 |
|
D |
2 molSO2和1 molO2,在相同温度下2SO2 + O2 |
SO3物质的量 |
2个大气压 |
10个大气压 |
查看答案和解析>>
科目: 来源:2012-2013学年黑龙江省高三上学期开学考试化学试卷(解析版) 题型:选择题
向27.2gCu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO 和Cu(NO3)2.在所得溶液中加入1.0mol/L 的NaOH溶液1.0L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2g。下列有关说法不正确的是:
A.Cu与Cu2O 的物质的量之比为2:1 B.硝酸的物质的量浓度为2.6mol/L
C.产生的NO在标准状况下体积为4.48L D.Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol
查看答案和解析>>
科目: 来源:2012-2013学年黑龙江省高三上学期开学考试化学试卷(解析版) 题型:选择题
图中是部分短周期元素化合价与原子序数的关系图,下列说法正确的是
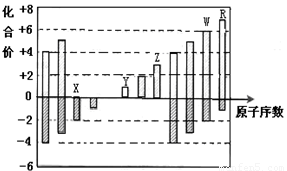
A.原子半径:Z>Y>X
B.气态氢化物的稳定性:R﹤W
C.WX3和水反应形成的化合物是离子化合物
D.Y和Z两者最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目: 来源:2012-2013学年黑龙江省高三上学期开学考试化学试卷(解析版) 题型:选择题
将足量的CO2不断通入KOH、Ba(OH)2、KA1O2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为:

查看答案和解析>>
科目: 来源:2012-2013学年黑龙江省高三上学期开学考试化学试卷(解析版) 题型:填空题
(8分)工业上采用的一种污水处理方法是:保持污水的pH在5.0-6.0之间,通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。某科研小组用此法处理污水,设计装置示意图,如图所示。
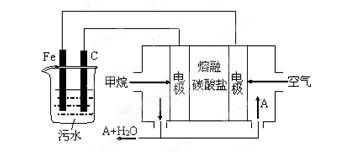
⑴实验时若污水中离子浓度较小,导电能力较差,无法使悬浮物形成浮渣。此时,应向污水中加入适量的__________。
a.BaSO4 b.CH3CH2OH c.Na2SO4 d.NaOH
⑵电解池阳极发生了两个电极反应,其中一个反应生成一种无色气体,则阳极的电极反应式分别是:
Ⅰ._____________________________;Ⅱ.______________________________。
⑶电极反应Ⅰ和Ⅱ的生成物反应得到Fe(OH)3沉淀的离子方程式是____________________。
⑷该燃料电池是以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,稀土金属材料做电极。为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(见上图)。A物质的化学式是_________________;
查看答案和解析>>
科目: 来源:2012-2013学年黑龙江省高三上学期开学考试化学试卷(解析版) 题型:填空题
(14分)1773年,伊莱尔·罗埃尔(Hilaire Rouelle)发现尿素。1828年,弗里德里希·维勒首次使用无机物质氰酸钾[KCNO]与硫酸铵人工合成了尿素[CO(NH2)2]。
(1)维勒合成尿素的化学反应方程式为 。
(2)工业上尿素是由CO2和NH3在一定条件下合成,其反应方程式为
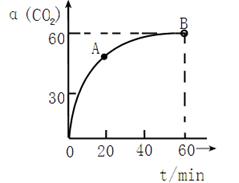
当氨碳比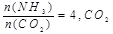 的转化率随时间的变化关系如图1所示。
的转化率随时间的变化关系如图1所示。
①A点速率v逆(CO2) 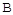 点速率为V正(CO2)(填“大于”、“小于”或“等于”)
点速率为V正(CO2)(填“大于”、“小于”或“等于”)
|
|
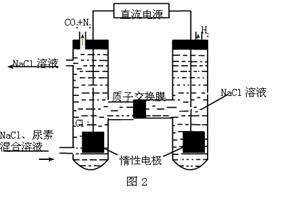
(3)人工肾脏可用间接电化学方法除去代谢产物中的尿素,原理如图2。
①电源的负极为 (填“A”或“B”)。
②阴极室中发生的电极反应式为
③电解结束后,阴极室溶液的pH与电解前相比将 (填“增大”、“减小”、“不变”)若两极共收集到气体11.2L(标准状况),则除去的尿素为 g(忽略气体的溶解)。
查看答案和解析>>
科目: 来源:2012-2013学年黑龙江省高三上学期开学考试化学试卷(解析版) 题型:实验题
(12分)某探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
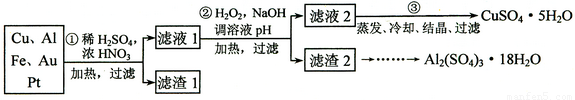
请回答下列问题:
⑴ 第①步Cu与酸反应的离子方程式______________ 。
⑵ 第②步加H2O2的作用是_______________;调溶液pH的目的是使____________生成沉淀。
⑶ 用第③步所得CuSO4·5H2O制备无水CuSO4的方法是______________。
⑷ 由滤渣2制取Al2(SO4)3·18H2O ,探究小组设计了三种方案:
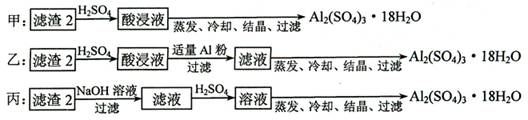
上述三种方案中,_______方案不可行,原因是_____________________________;
从原子利用率角度考虑,___________方案更合理。
⑸ 探究小组用滴定法测定CuSO4·5H2O含量。取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol /L EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液6 mL。滴定反应如下:Cu2+ + H2Y2- = CuY2- + 2H+
写出计算CuSO4·5H2O质量分数的表达式ω= _____________________________ ;
下列操作会导致CuSO4·5H2O含量的测定结果偏高的是_____________。
a.未干燥锥形瓶
b.滴定终点时滴定管尖嘴中产生气泡
c.未除净可与EDTA反应的干扰离子
查看答案和解析>>
科目: 来源:2012-2013学年黑龙江省高三上学期开学考试化学试卷(解析版) 题型:填空题
(11 分)已知 A、B、D为中学常见的单质,甲、乙、丙、丁、戊为短周期元素组成的化合物。其中,丙是一种能使湿润的红色石蕊试纸变蓝的无色气体;丁是一种高能燃料,其组成元素与丙相同,1 mol 丁分子中不同原子的数目比为1 :2,且含有18 mol电子;戊是一种难溶于水的白色胶状物质,既能与强酸反应,也能与强碱反应,具有净水作用。各物质间的转化关系如下图所示(某些条件已略去)。

请回答:(1)单质B的组成元素在周期表中的位置是_________。
(2)戊的化学式为________。戊与强碱反应的离子方程式:________________
(3)丙中所包含的化学键类型有________ (填字母序号)。
a.离子键 b.极性共价键 c.非极性共价键
(4)反应①的化学方程式为________________________。
(5)反应②中,0.5mol NaClO参加反应时,转移1 mol电子,其化学方程式为_________
(6)—定条件下,A与TiO2、C(石墨)反应只生成乙和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分。已知,该反应生成1 mol乙时放出536 kJ热量,其热化学方程式为_______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com