
科目: 来源:2012-2013学年湖南望城一中、长沙县实验中学高三10月联考化学试卷(解析版) 题型:选择题
已知乙烷的燃烧热为1190kJ/mol,则下列表述正确的是( )
A.2C2H6(g)+7O2 (g) = 4CO2 (g)+6H2O(l);△H=-1190kJ/mol
B.C2H6(g)+7/2O2 (g) =2CO2 (g)+3H2O(g);△H=-1190kJ/mol
C.298k、101kPa时,30g乙烷气体完全燃烧生成CO2气体和液态水,放出1190kJ热量;
D.该反应中,反应物所具有的总能量小于生成物所具有的总能量。
查看答案和解析>>
科目: 来源:2012-2013学年湖南望城一中、长沙县实验中学高三10月联考化学试卷(解析版) 题型:选择题
PCl3和PCl5都是重要的化工原料。将PCl3(g)和Cl2(g)充入体积不变的2 L密闭容器中,在一定条件下发生下述反应,并于10 min时达到平衡:PCl3(g)+Cl2(g)  PCl5(g) △H<0。有关数据如下:
PCl5(g) △H<0。有关数据如下:
|
|
PCl3(g) |
Cl2(g) |
PCl5(g) |
|
初始浓度/(mol/L) |
2.0 |
1.0 |
0 |
|
平衡浓度/(mol/L) |
(1.6)c1 |
(0.6)c2 |
0.4 |
下列判断不正确的是( )
A.10 min内,v(Cl2)=0.04 mol/(L·min)
B.当容器中Cl2为1.2 mol时,反应达到平衡
C.升高温度,反应的平衡常数减小,则平衡时PCl3的转化率变大
D.平衡后移走2.0 mol PCl3和1.0 mol Cl2,在相同条件下再达平衡时,
c(PCl5)<0.2 mol/L
查看答案和解析>>
科目: 来源:2012-2013学年湖南望城一中、长沙县实验中学高三10月联考化学试卷(解析版) 题型:选择题
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
① CH3OH(g)+H2O(g)===CO2(g)+3H2(g);ΔH=+49.0 kJ/mol
② CH3OH(g)+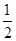 O2(g)===CO2(g)+2H2(g);ΔH=-192.9 kJ/mol
O2(g)===CO2(g)+2H2(g);ΔH=-192.9 kJ/mol
下列说法正确的是 ( )
A.CH3OH的燃烧热为192.9 kJ/mol
B.反应①中的能量变化如图所示

C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应:CH3OH(l)+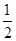 O2(g)===CO2(g)+2H2(g)的ΔH>-192.9 kJ/mol
O2(g)===CO2(g)+2H2(g)的ΔH>-192.9 kJ/mol
查看答案和解析>>
科目: 来源:2012-2013学年湖南望城一中、长沙县实验中学高三10月联考化学试卷(解析版) 题型:选择题
下列装置或操作能达到实验目的的是( )
A.装置①可用于测定H2O2分解的反应速率
B.装置②中X为苯,可用于吸收氨气或氯化氢
C.装置③可用于实验室从食盐水中提取氯化钠
D.装置④可用于证明氧化性:KMnO4>Cl2>S
查看答案和解析>>
科目: 来源:2012-2013学年湖南望城一中、长沙县实验中学高三10月联考化学试卷(解析版) 题型:实验题
(14分)现有一定量含有Na2O杂质的Na2O2试样,用图K2-6-2所示的实验装置测定Na2O2试样的纯度。(可供选用的试剂只有CaCO3固体、6 mol/L盐酸、6 mol/L硫酸和蒸馏水)
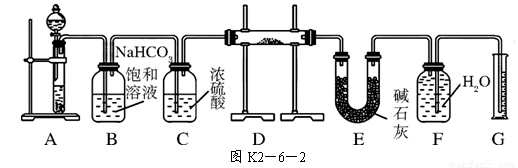
回答下列问题:
(1)装置A中液体试剂选用____________,理由是__________________________。
(2)装置B的作用是______________________,装置E中碱石灰的作用是_____________ ____________________________。
(3)装置D中发生反应的化学方程式是:
_______ ___________________________、_______ __________________________。
(4)若开始时测得样品的质量为2.0 g,反应结束后测得气体体积为224 mL(标准状况),则Na2O2试样的纯度为______。
查看答案和解析>>
科目: 来源:2012-2013学年湖南望城一中、长沙县实验中学高三10月联考化学试卷(解析版) 题型:填空题
(8分)下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是由第三周期元素组成的单质中熔点最高的金属, K是一种红棕色气体。

(提示:4FeS2+11O2 2Fe2O3+8SO2)
2Fe2O3+8SO2)
请填写下列空白:
(1)在周期表中,组成单质G的元素位于第__________周期_________族。
(2)在反应⑦中氧化剂与还原剂的物质的量之比为___________________。
(3)在②、③、⑥、⑨中既属于化合反应又属于非氧化还原反应的是___________(填序号)
(4)反应④的离子方程式是:______________________________________________。
(5)将化合物D与KNO3、KOH共融,可制得一种“绿色”环保高效净水剂K2FeO4(高铁酸钾),同时还生成KNO2和H2O。该反应的化学方程式是:___________________________________。
查看答案和解析>>
科目: 来源:2012-2013学年湖南望城一中、长沙县实验中学高三10月联考化学试卷(解析版) 题型:填空题
(14分)某课外小组分别用下图所示装置对原电池和电解原理进行实验探究。
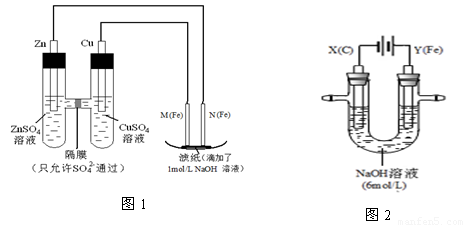
请回答:
I.用图1所示装置进行第一组实验。
(1)在保证电极反应不变的情况下,不能替代Cu做电极的是 (填字母序号)。
A.铝 B.石墨 C.银 D.铂
(2)N极发生反应的电极反应式为 。
(3)实验过程中,SO42- (填“从左向右”、“从右向左”或“不”)移动;滤纸上能观察到的现象有 。
II.用图2所示装置进行第二组实验。实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色。
(4)电解过程中,X极区溶液的pH (填“增大” 、“减小”或“不变”)。
(5)电解过程中,Y极发生的电极反应为Fe - 6e- + 8OH- =FeO42- + 4H2O 和
4OH- - 4e- = 2H2O + O2↑ , 若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少 g。
(6)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为:
2K2FeO4 + 3Zn =Fe2O3 +ZnO +2K2ZnO2
该电池正极发生的反应的电极反应式为 。
查看答案和解析>>
科目: 来源:2012-2013学年湖南望城一中、长沙县实验中学高三10月联考化学试卷(解析版) 题型:填空题
(10分)在一固定容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g) 2NH3(g)
△H<0 。反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:
2NH3(g)
△H<0 。反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:
⑴ 根据下图,计算从反应开始到平衡时,平均反应速率v(NH3)=______________________________
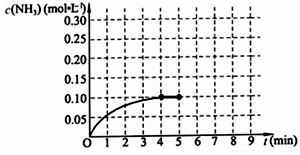
⑵ 该反应450℃的平衡常数________500℃时的平衡常数(填“>”、“<”或“=”)。
⑶ 下列描述中能说明上述反应已达平衡的是___________。
A.3v正(H2)=2v逆(NH3)
B.容器中气体的平均相对分子量不随时间而变化
C.容器中气体的密度不随时间而变化
D.容器中气体的分子总数不随时间而变化
⑷ 第5分钟末,保持恒温恒压,若继续通入0.2mol的N2和0.6mol的H2,平衡_______________移动(填“向正反应方向”、“向逆反应方向”或“不”)。
⑸ 第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3浓度约为0.25mol/L),请在上图中画出第5分钟末到此平衡时NH3浓度的变化曲线。
查看答案和解析>>
科目: 来源:2012-2013学年湖南省岳阳市高三第一次质量检测化学试卷(解析版) 题型:选择题
下列表示物质结构的化学用语或模型正确的是( )
A.8个中子的氧原子的核素符号: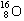 B.HF的电子式:
B.HF的电子式: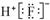
C.K+离子的结构示意图: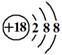 D.CH4分子的球棍模型:
D.CH4分子的球棍模型:
查看答案和解析>>
科目: 来源:2012-2013学年湖南省岳阳市高三第一次质量检测化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的数值,下列说法正确的是( )
A.lmol Na2O2晶体中共含有4NA个离子
B.0.1mol AlCl3完全水解转化为氢氧化铝胶体,生成0.1NA个胶粒
C.常温常压下16gO2和O3混合气体含有NA个氧原子
D.电解精炼铜时每转移NA个电子,阳极溶解32g铜
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com