
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
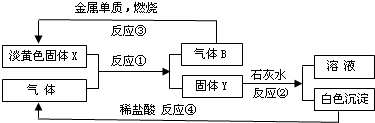
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
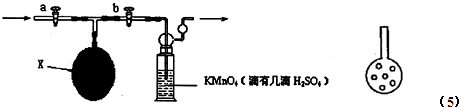
| 滴定 次数 | 量取KMnO4溶液的体积(mL) | 标准草酸溶液的体积 | 平均值 (mL) | ||
| 滴定前刻度 | 滴定后刻度 | 实际体积(mL) | |||
| 第一次 | 5.00 | 0.00 | 19.60 | ||
| 第二次 | 5.00 | 0.20 | 19.60 | ||
| 第三次 | 5.00 | 0.06 | 18.06 | ||
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:单选题
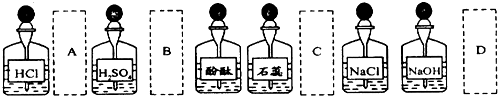
查看答案和解析>>
科目: 来源: 题型:多选题
查看答案和解析>>
科目: 来源: 题型:解答题
 2SO3(g)△H=-98.3kJ?mol-1
2SO3(g)△H=-98.3kJ?mol-1查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com