
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
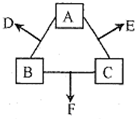 A、B、C三种非金属元素的质子数之和为16,它们的单质在一定条件下两两化合可以生成三种常见的化合物D、E、F.D、F的一个分子中只含有10个电子,常温下D是一种液体,E是一种无色的气体.
A、B、C三种非金属元素的质子数之和为16,它们的单质在一定条件下两两化合可以生成三种常见的化合物D、E、F.D、F的一个分子中只含有10个电子,常温下D是一种液体,E是一种无色的气体.查看答案和解析>>
科目: 来源: 题型:单选题
SO2与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生的两个化学反应如下:
①SO2+2Fe3++2H2O═SO42-+2Fe2++4H+,②Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O.
下列有关说法正确的是
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:单选题
 MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑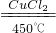 2H2O+2Cl2
2H2O+2Cl2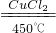 2H2O+2Cl2
2H2O+2Cl2查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com