
科目: 来源:2014届江西省高二十月月考化学试卷(解析版) 题型:选择题
人体血液内的血红蛋白(Hb)易与O2结合生成HbO2,
因此具有输氧能力,CO吸入肺中发生反应:CO+HbO2 O2+HbCO,37 ℃时,该反应的平衡常数K=220。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是(
)
O2+HbCO,37 ℃时,该反应的平衡常数K=220。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是(
)
A.CO与HbO2反应的平衡常数K=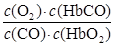
B.人体吸入的CO越多,与血红蛋白结合的O2越少
C.当吸入的CO与O2浓度之比大于或等于0.02时,人的智力才会受损
D.把CO中毒的病人放入高压氧仓中解毒,其原理是使上述平衡向左移动
查看答案和解析>>
科目: 来源:2014届江西省高二十月月考化学试卷(解析版) 题型:选择题
反应速率v和反应物浓度的关系是用实验方法测定的,化学反应H2+Cl2=2HCl的反应速率v可表示为v=K[c(H2)]m[c(Cl2)]n,式中K为常数,m、n的值可用下表中的数据确定。
|
c(H2)(mol·L-1) |
c(Cl2)(mol·L-1) |
v(mol·L-1·s-1) |
|
1.0 |
1.0 |
1.0K |
|
2.0 |
1.0 |
2.0K |
|
2.0 |
4.0 |
4.0K |
由此可推得m、n的值正确的是( )
A. m=1,n=1? B. m=1/2,n=1/2? C. m=1/2,n=1 D. m=1,n=1/2
查看答案和解析>>
科目: 来源:2014届江西省高二十月月考化学试卷(解析版) 题型:选择题
化合物HIn在水溶液中因存在以下电离平衡,故可用作酸碱指示剂
HIn(溶液)  H+(溶液)+In-(溶液)
H+(溶液)+In-(溶液)
红色 黄色
浓度为0.02 mol·L-1的下列各溶液 ①盐酸 ②石灰水 ③NaCl溶液 ④NaHSO4溶液 ⑤NaHCO3溶液 ⑥氨水,其中能使指示剂显红色的是 ( )
A. ②⑤⑥ B. ①④ C. ①④⑤ D. ②③⑥
查看答案和解析>>
科目: 来源:2014届江西省高二十月月考化学试卷(解析版) 题型:选择题
将一定量的氨基甲酸铵固体置于某容积恒定的真空容器中,发生反应: H2NCOONH4(s) 2NH3(g)+CO2(g)。在不同温度下,该反应平衡状态部分数据见右表。下列说法正确的是
2NH3(g)+CO2(g)。在不同温度下,该反应平衡状态部分数据见右表。下列说法正确的是
|
|
平衡浓度/ (mol L-1) |
|
|
c(NH3) |
c(CO2) |
|
|
T1 |
0.1 |
|
|
T2 |
|
0.1 |
A.若T2>T1,则该反应的ΔH<0
B.向容器中充入N2,H2NCOONH4质量增加
C.NH3体积分数不变时,说明该反应达到平衡
D.T1、T2时,H2NCOONH4转化的物质的量:Δn(T2)=2Δn(T1)
查看答案和解析>>
科目: 来源:2014届江西省高二十月月考化学试卷(解析版) 题型:填空题
(3分)发射卫星用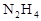 作燃料,
作燃料,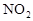 作氧化剂,两者反应生成N2和水蒸气,已知:
作氧化剂,两者反应生成N2和水蒸气,已知:
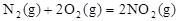 △H1 =+67.7kJ/mol
△H1 =+67.7kJ/mol
N2H4(g)+O2(g)= N2(g)+2H2O(g) △H2=-534kJ/mol
试写出N2H4与 NO2反应的热化学方程式
。
查看答案和解析>>
科目: 来源:2014届江西省高二十月月考化学试卷(解析版) 题型:填空题
(10分)在密闭容器里,通入x mol H2(g)和y mol I2(g),发生反应:
H2(g)+I2(g) 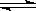 2HI(g)
△H
<0。改变下列条件,反应速率将如何改变?(选填“增大”“减小”或“不变”)
2HI(g)
△H
<0。改变下列条件,反应速率将如何改变?(选填“增大”“减小”或“不变”)
(1)升高温度 ;
(2)加入催化剂 ;
(3)充入更多的H2 ;
(4)扩大容器的体积 ;
(5)保持容器容积不变,通入氖气 。
查看答案和解析>>
科目: 来源:2014届江西省高二十月月考化学试卷(解析版) 题型:填空题
(8分)在一定条件下,可逆反应:mA+nB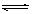 pC达到平衡,若:
pC达到平衡,若:
(1)A、B、C都是气体,减少压强,平衡向正反应方向移动,则m+n和p的关系是 。
(2)A、C是气体,增加B的量,平衡不移动,则B为 态。
(3)A、C是气体,而且m+n=p,增大压强可使平衡发生移动,则平衡移动的方向是 。
(4)加热后,可使C的质量增加,则正反应是 反应(放热或吸热)。
查看答案和解析>>
科目: 来源:2014届江西省高二十月月考化学试卷(解析版) 题型:填空题
(8分)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
□SiO2+□C+□N2 □Si3N4+□CO
□Si3N4+□CO
(1)配平上述反应的化学方程式(将化学计量数填在方框内);
(2)该反应的氧化剂是 ,其还原产物是 ;
(3)若知上述反应为放热反应,则其反应热△H 零(填“大于”、“小于”或“等于”);升高温度,其平衡常数值 (填“增大”、“减小”或“不变”);
(4)若使压强增大,则上述平衡向 反应方向移动(填“正”或“逆”);
(5)若已知CO生成速率为v(CO)=18mol/(L.min),则N2消耗速速率为v(N2)= mol/(L.min)。
查看答案和解析>>
科目: 来源:2014届江西省高二十月月考化学试卷(解析版) 题型:实验题
氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工产品。某研究小组用粗铜(含杂质Fe)按下述流程制备氯化铜晶体(CuCl2·2H2O)。
(1)实验室采用如下图所示的装置,可将粗铜与Cl2反应转化为固体1(部分仪器和夹持装置已略去)。

① 仪器A的名称是 。
② 装置B中发生反应的离子方程式是 。
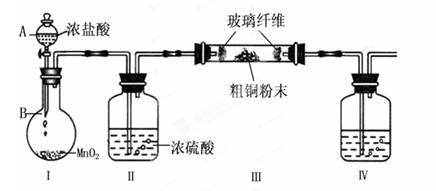 ③ 有同学认为应在浓硫酸洗气瓶前增加吸收HCl的装置,你认为是否必要(填“是”或“否”) 。
③ 有同学认为应在浓硫酸洗气瓶前增加吸收HCl的装置,你认为是否必要(填“是”或“否”) 。
④装置Ⅳ中盛装的试剂是 ,其作用是 。
(2)在CuCl2溶液转化为CuCl2·2H2O的操作过程中,发现溶液颜色由蓝色变为黄绿色。小组同学欲探究其原因。
已知:在氯化铜溶液中有如下转化关系:
Cu(H2O)42+(aq)
+4Cl-(aq)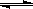 CuCl42-(aq) +4H2O(l)
CuCl42-(aq) +4H2O(l)
蓝色 黄色
① 上述反应的化学平衡常数表达式是K= 。若增大氯离子浓度,K值(填“增大”、“减小”或“不变”) 。
② 现欲使溶液由黄色变成黄绿色或蓝色,请写出两种可采用的方法
a. b. 。
查看答案和解析>>
科目: 来源:2014届江西省高二十月月考化学试卷(解析版) 题型:计算题
已知反应:FeO(s)+CO(g) = Fe(s)+CO2(g) 的Kc=0.5(1273K)。若起始浓度c(CO)=0.05 mol/L,c(CO2)=0.01 mol·L-1,请回答:
(1)计算CO 和CO2平衡浓度。
(2)CO的转化率是多少?
(3)增加FeO的量,对平衡有无影响?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com