
科目: 来源:2014届云南省昆明市高二9月月考化学试卷(解析版) 题型:选择题
反应4A(g)+3B(g) 2C(g)+D(g),经2min,B的浓度减少0.6 mol•L-1。对此反应速率的表示,正确的是
2C(g)+D(g),经2min,B的浓度减少0.6 mol•L-1。对此反应速率的表示,正确的是
①用A表示的反应速率是0.4 mol•L-1•min-1
②分别用B、C、D表示的反应速率其比值为3:2:1
③在2 min末的反应速率,用B表示是0.3 mol•L-1•min-1
④在这2 min内用B表示的反应速率的值是逐渐减小的,用C表示的反应速率的值是逐渐增大的
A. ①② B.③ C.① D. ②④
查看答案和解析>>
科目: 来源:2014届云南省昆明市高二9月月考化学试卷(解析版) 题型:选择题
在C(s)+CO2(g)===2CO(g)的反应中,现采取下列措施:
①缩小体积,增大压强 ②增加碳的量 ③通入CO2 ④恒容下充入N2 ⑤恒压下充入N2能够使反应速率增大的措施是
A.①④ B.②③⑤ C.①③ D.①②④
查看答案和解析>>
科目: 来源:2014届云南省昆明市高二9月月考化学试卷(解析版) 题型:选择题
在一定条件下,反应:2NO+O2 2NO2在定容容器中发生,对该反应达到平衡的标志的描述中,错误的是
2NO2在定容容器中发生,对该反应达到平衡的标志的描述中,错误的是
①混合气体的总分子数不再变化 ②混合气体的颜色不再变化 ③容器的总压强不再变化 ④混合气体的总质量不再变化 ⑤混合气体的密度不再变化 ⑥单位时间内生成n mol的NO,同时消耗n mol的NO2 ⑦反应的温度不再发生变化(绝热条件)
A. ①②③⑦ B. ④⑤⑥ C. ①②④ D. ③⑦⑤⑥
查看答案和解析>>
科目: 来源:2014届云南省昆明市高二9月月考化学试卷(解析版) 题型:选择题
COCl2(g) CO(g)+Cl2(g) ΔH>0,当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,其中能提高COCl2转化率的是
CO(g)+Cl2(g) ΔH>0,当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,其中能提高COCl2转化率的是
A.①②④ B.①④⑥ C.②③⑤ D.③⑤⑥
查看答案和解析>>
科目: 来源:2014届云南省昆明市高二9月月考化学试卷(解析版) 题型:选择题
某密闭容器中发生如下反应:X(g)+3Y(g) 2Z(g)
ΔH<0,如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是
2Z(g)
ΔH<0,如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是
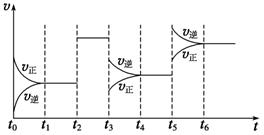
A.t2时加入了催化剂 B.t3时降低了温度
C.t5时增大了压强 D.t4~t5时间内转化率最低
查看答案和解析>>
科目: 来源:2014届云南省昆明市高二9月月考化学试卷(解析版) 题型:实验题
(共6分)实验室用50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:

|
实验次数 |
起始温度t1/℃ |
终止温度t2/℃ |
|
|
盐酸 |
NaOH溶液 |
||
|
1 |
20.2 |
20.3 |
23.7 |
|
2 |
20.3 |
20.5 |
23.8 |
|
3 |
21.5 |
21.6 |
24.9 |
完成下列问题:
(1)实验时不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是 。
(2)在操作正确的前提下,提高中和热测定准确性的关键是 。
(3)根据上表中所测数据进行计算,则该实验测得的中和热ΔH= [盐酸和NaOH溶液的密度按1 g·cm-3计算,反应后混合溶液的比热容(c)按4.18 J·(g·℃)-1计算]。如用0.5 mol/L的盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将 (填“偏大”、“偏小”、 “不变”)。
(4)若某同学利用上述装置做实验,有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是
A.测量盐酸的温度后,温度计没有用水冲洗干净
B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温较高
D.将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水
E.在量取盐酸时仰视计数
F.大烧杯的盖板中间小孔太大
查看答案和解析>>
科目: 来源:2014届云南省昆明市高二9月月考化学试卷(解析版) 题型:填空题
(共10分)
(1)在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子。使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ·mol-1表示。请认真观察下图,然后回答问题。

①图中所示反应是 (填“吸热”或“放热”)反应,该反应 (填“需要”、“不需要”或“不一定”)加热,该反应的△H = (用含E1、E2的代数式表示)。
②对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子百分数增多,反应速率加快,你认为最可能的原因是____________________________________。
(2)把煤作为燃料可通过下列两种途径:
途径Ⅰ ①C(s)+O2(g) === CO2(g) ΔH1<0
途径Ⅱ 先制水煤气:②C(s)+H2O(g) === CO(g)+H2(g) ΔH2>0
再燃烧水煤气:
③2CO(g)+O2(g) === 2CO2(g) ΔH3<0 ④2H2(g)+O2(g) === 2H2O(g) ΔH4<0
请回答下列问题:
①判断两种途径放热:途径Ⅰ放出的热量________途径Ⅱ放出的热量(填“大于”、“等于”或“小于”)。
②ΔH1、ΔH2、ΔH3、ΔH4的数学关系是_________________________________。
③由于制取水煤气的反应里,反应物具有的总能量________(填“大于”“等于”或“小于”)生成物具有的总能量,那么在化学反应时,反应物就需要________能量才能转化为生成物,因此其反应条件为________。
(3)已知:Fe2O3(s)+3CO(g) === 2Fe(s)+3CO2(g) ΔH1=-25 kJ·mol-1 ①
3Fe2O3(s)+CO(g) === 2Fe3O4(s)+CO2(g) ΔH2=-47 kJ·mol-1 ②
Fe3O4(s)+CO(g) === 3FeO(s)+CO2(g) ΔH3=+19 kJ·mol-1 ③
请写出CO还原FeO的热化学方程式:______________________________________。
查看答案和解析>>
科目: 来源:2014届云南省昆明市高二9月月考化学试卷(解析版) 题型:填空题
(共8分)
在2 L恒容密闭容器中,800 ℃时反应2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
|
时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
|
n(NO)(mol) |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)如图中表示NO2的变化的曲线是 。
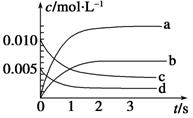
(2)求 2 s末用氧气表示的平均反应速率v(O2)=
(3)求达平衡时NO的转化率为
(4)能说明该反应已经达到平衡状态的是 。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v(NO)逆=2v(O2)正 d.容器内的密度保持不变
(5)能够使该反应的反应速率增大,且平衡向正反应方向移动的是 。
a.及时分离出NO2气体 b.增大O2的浓度
查看答案和解析>>
科目: 来源:2014届云南省昆明市高二9月月考化学试卷(解析版) 题型:计算题
(共16分)
(1)现有反应:mA(g)+nB(g)  pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
①该反应的逆反应为______反应(填“吸热”或“放热”),且m+n______ p (填“>”、“=”或“<”)。
②减压使容器体积增大时,A的质量分数________。(填“增大”、“减小”或“不变”,下同)
③若容积不变加入B,则A的转化率__________,B的转化率________。
④若升高温度,则平衡时B、C的浓度之比  将________。
将________。
⑤若加入催化剂,平衡时气体混合物的总物质的量________________________________
(2)在一容积为2 L的密闭容器中,加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应:
N2(g)+3H2(g) 2NH3(g) ΔH<0。反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题:
2NH3(g) ΔH<0。反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题:

在第5 min末将容器的体积缩小一半后,若在第8 min末达到新的平衡(此时NH3的浓度约为0.25 mol·L-1),请在图中画出第5 min末到平衡时NH3浓度的变化曲线。
查看答案和解析>>
科目: 来源:2014届内蒙古巴彦淖尔市高二9月月考化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.放热反应不需加热即可发生
B.化学反应过程中的能量变化除了热能外,也可以是光能、电能等
C.需要加热才能进行的化学反应不一定是吸热反应
D.化学反应热效应数值与参加反应的物质多少有关
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com