
科目: 来源:2012-2013学年甘肃省高三9月月考化学试卷(解析版) 题型:填空题
(11分)A、B、C、D、E五种可溶性化合物,分别由阳离子Fe3+、Ba2+、Al3+、Na+、Ag+和阴离子NO3-、OH-、SO42-、Cl-、CO32-中的各一种组成(离子不重复)。现做如下实验:
①A和E的溶液显碱性,0.1mol·L-1A溶液的pH小于13;
②在B的溶液中逐滴加入氨水有白色沉淀生成,继续加氨水至过量,沉淀消失;
③在C的溶液中加入铁粉,溶液的质量增加;
④在D的溶液中加入过量的Ba(OH)2溶液,没有沉淀。
请回答下列问题:
(1)根据以上事实推断A—E的化学式:
A ;B ;C ;D ;E 。
(2)请用离子方程式表示A溶液显碱性的原因 。
(3)写出③、④的离子方程式:③ ;④ 。
查看答案和解析>>
科目: 来源:2012-2013学年甘肃省高三9月月考化学试卷(解析版) 题型:填空题
(9分)高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂。工业上可以通过次氯酸钠氧化法制备高铁酸钠,生产过程如下:
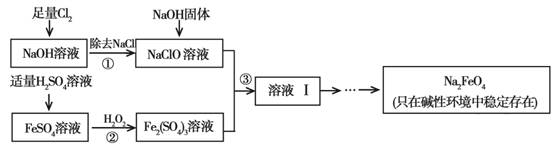
回答下列问题:
(1)经过步骤①后,加入NaOH固体的原因是____ ____。
(2)步骤②反应的离子方程式是_____ ___。
(3)从溶液Ⅰ中分离出Na2FeO4后,还有副产品Na2SO4 、NaCl,则步骤③中反应的离
子方程式为___ _____。
(4)将一定量的Na2FeO4投入到pH不同的污水中(污水中其余成分均相同),溶液中Na2FeO4浓度变化如下图曲线Ⅰ、Ⅱ所示,试推测曲线I比曲线II对应的污水pH_____(填“高”或“低”)。

(5)通过计算得知Na2FeO4的消毒效率(以单位质量得到的电子数表示)比氯气的_____(填“高”或“低”),用高铁酸钠代替氯气作净水消毒剂的优点是____ (答出两点即可)。
查看答案和解析>>
科目: 来源:2012-2013学年甘肃省高三9月月考化学试卷(解析版) 题型:实验题
(8分)我国制碱工业的先驱 侯德榜先生,1939年发明了著名的侯氏制碱法,其核心反应原理可用如下化学方程式表示:
侯德榜先生,1939年发明了著名的侯氏制碱法,其核心反应原理可用如下化学方程式表示:
NH3+CO2+NaCl+H2O=NH4Cl+NaHCO3(晶体)
依据此原理,欲制得碳酸氢钠晶体,某校学生设计了如下实验装置,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和。
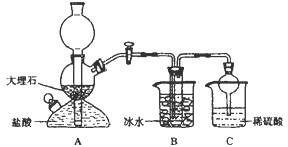
(1)A装置中所发生反应的离子方程式为 。
C装置中稀硫酸的作用为 。
(2)下表中所列出的是相关物质在不同温度下的溶解度数据(g/100g水)
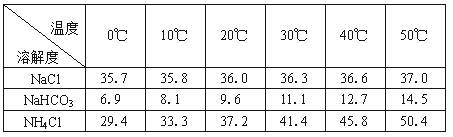
参照表中数据,请分析B装置中使用冰水的目的是 。
(3)该校学生在检查完此套装置气密性后进行实验,结果没有得到碳酸氢钠晶体,指导教师指出应在 装置之间(填写字母)连接一个盛有 的洗气装置,其作用是 。
查看答案和解析>>
科目: 来源:2012-2013学年甘肃省高三9月月考化学试卷(解析版) 题型:计算题
(4分)硝酸铜受热易分解:2Cu(NO3)2  2CuO+4NO2↑+O2↑,当温度达到800℃时,CuO开始分解:4CuO
2CuO+4NO2↑+O2↑,当温度达到800℃时,CuO开始分解:4CuO  2Cu2O+
O2↑,至1000℃以上,CuO完全分解(加热过程中忽略2NO2
2Cu2O+
O2↑,至1000℃以上,CuO完全分解(加热过程中忽略2NO2 N2O4,2NO2=2NO+O2等反应)。
N2O4,2NO2=2NO+O2等反应)。
现取5.64gCu(NO3)2无水晶体,在一定温度下使其分解,将生成的气体及时导出并用足量的NaOH溶液充分吸收。
⑴若该质量的无水硝酸铜经加热完全分解,其中的铜元素全部转化为氧化铜,则氧化铜的质量是__________g。
⑵若该质量的无水硝酸铜完全分解,铜元素全部转化为氧化亚铜,反应过程中生成的气体被足量的NaOH溶液充分吸收后,还有多余的气体,则多余的气体是________(填分子式),其体积(标准状况)是_____________L。
⑶若该质量的无水硝酸铜分解后的残留固体中含有1.60g CuO,则残留固体的质量可能
是_________g。
查看答案和解析>>
科目: 来源:2012-2013学年甘肃省高三第二次检测考试化学试卷(解析版) 题型:选择题
在标准状况下,若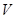 L甲烷中含有的氢原子个数为
L甲烷中含有的氢原子个数为 ,则阿伏加德罗常数可表示为( )
,则阿伏加德罗常数可表示为( )
A. B.
B. C.
C.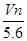 D.
D.
查看答案和解析>>
科目: 来源:2012-2013学年甘肃省高三第二次检测考试化学试卷(解析版) 题型:选择题
科学家已发现一种新型氢分子,其化学式为H3,在相同条件下,等质量的H3和H2相同的是( )
A.原子数 B.分子数 C.体积 D.物质的量
查看答案和解析>>
科目: 来源:2012-2013学年甘肃省高三第二次检测考试化学试卷(解析版) 题型:选择题
欲配制100ml 1.0 mol/L Na2SO4溶液,正确的方法是( )
① 将14.2 g Na2SO4 溶于100ml水中
② 将32.2g Na2SO4·10H2O溶于少量水中,再用水稀释至100 ml
③ 将20 ml 5.0 mol/L Na2SO4溶液用水稀释至100 ml
A.①② B.②③ C.①③ D.①②③
查看答案和解析>>
科目: 来源:2012-2013学年甘肃省高三第二次检测考试化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数,下列说法正确的是( )
A.标准状况下,5.6L四氯化碳含有的分子数为0.25NA
B.标准状况下,14g氮气含有的核外电子数为5NA
C.标准状况下,22.4L任意比的氮气和氯气的混合气体中含有的分子总数均为NA
D.标准状况下,铝跟氢氧化钠溶液反应生成1mol氢气时,转移的电子数为NA
查看答案和解析>>
科目: 来源:2012-2013学年甘肃省高三第二次检测考试化学试卷(解析版) 题型:选择题
吸入人体內的氧有2%转化为氧化性极强的“活性氧”,它能加速人体衰老,被称为“生命杀手”,服用含硒元素(Se)的化合物亚硒酸钠(Na2SeO3),能消除人体內的活性氧,由此推断Na2SeO3的作用是
A.作还原剂 B.作氧化剂
C.既作氧化剂又作还原剂 D.既不作氧化剂又不作还原剂
查看答案和解析>>
科目: 来源:2012-2013学年甘肃省高三第二次检测考试化学试卷(解析版) 题型:选择题
只用一种试剂,可区别Na2SO4、AlCl3、NH4Cl、MgSO4四种溶液,这种试剂是( )
A.HCl B.BaCl2 C.NaOH D.AgNO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com