
科目: 来源:2012-2013学年江苏省高三10月阶段练习化学试卷(解析版) 题型:选择题
锰酸锂离子蓄电池是第二代锂离子动力电池。它的问世使得锂离子动力电池在纯电动汽车与混合动力车等大型蓄电池应用领域占据主导地位。电池反应式为:Li1-xMnO4+LixC  LiMnO4+C。
LiMnO4+C。

下列有关说法正确的是
A.充电时电池内部Li+向正极移动
B.放电过程中,电能转化为化学能
C.放电时电池的正极反应式为:Li1-xMnO4+xe—+xLi+=LiMnO4
D.充电时电池上标注有“+”的电极应于外接电源的负极相连
查看答案和解析>>
科目: 来源:2012-2013学年江苏省高三10月阶段练习化学试卷(解析版) 题型:选择题
下列说法正确的是
A.常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4
B.为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸
C.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol·L—1盐酸、③0.1 mol·L—1氯化镁溶液、④0.1 mol·L—1硝酸银溶液中,Ag+浓度:①>④=②>③
D.用0.2000 mol·L—1NaOH标准溶液滴定HCl与CH3COOH的混合溶液(混合液中两种酸的浓度均约为0.1 mol·L—1),至中性时,溶液中的酸未被完全中和
查看答案和解析>>
科目: 来源:2012-2013学年江苏省高三10月阶段练习化学试卷(解析版) 题型:选择题
以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如下:
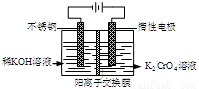
下列说法不正确的是
A.在阴极室,发生的电极反应为:2H2O+2e—=2OH—+H2↑
B.在阳极室,通电后溶液逐渐由黄色变为橙色,是因为H+浓度增大,使平衡
2CrO42—+2H+ Cr2O72—+H2O向右移动
Cr2O72—+H2O向右移动
C.该制备过程总反应的化学方程式为:4K2CrO4+4H2O 2K2Cr2O7+4KOH+2H2↑+O2↑
2K2Cr2O7+4KOH+2H2↑+O2↑
D.测定阳极液中K和Cr的含量,若K与Cr的物质的量之比(nK/nCr )为d,则此时铬酸钾的转化率为1-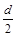
查看答案和解析>>
科目: 来源:2012-2013学年江苏省高三10月阶段练习化学试卷(解析版) 题型:选择题
下列叙述的实验能达到预期目的的是:
|
|
实验内容 |
实验目的 |
|
A |
在稀AgNO3溶液中加入少量NaCl溶液产生白色沉淀后再加入适量NaI溶液,出现黄色沉淀 |
说明Ksp(AgCl)>Ksp(AgI) |
|
B |
分别向2支试管中加入等体积等浓度的Na2S2O3溶液,再向其中分别加入等体积不同浓度的H2SO4溶液 |
研究反应物浓度对化学反应速率的影响 |
|
C |
向混有亚硫酸钠的硫酸钠溶液中加入适量的BaCl2溶液 |
检验SO42-存在 |
|
D |
向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液 |
制备Fe(OH)3胶体 |
查看答案和解析>>
科目: 来源:2012-2013学年江苏省高三10月阶段练习化学试卷(解析版) 题型:选择题
取一张用饱和NaCl溶液浸泡的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现a电极与试纸接触处出现一个双色同心圆,内圆为白色,外圈呈浅红色。则下列说法错误的是

A.M是直流电的正极
B.电子流向是N→b→a→M
C.电解过程中,水是氧化剂
D.b电极附近溶液的pH变小
查看答案和解析>>
科目: 来源:2012-2013学年江苏省高三10月阶段练习化学试卷(解析版) 题型:选择题
100 mL KNO3和Cu(NO3)2的混合溶液中c(NO3—)=6.0 mol/L,用石墨作电极电解此溶液,通电一段时间后,两极均收集到4.48 L气体(标准状况),假定电解后溶液体积仍为100 mL,下列说法不正确的是
A.原混合溶液中c(K+)=1 mol/L
B.上述电解过程中一共转移电子0.8 mol
C.电解得到的铜的物质的量为0.2 mol
D.电解后溶液中c(H+)=2 mol/L
查看答案和解析>>
科目: 来源:2012-2013学年江苏省高三10月阶段练习化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合:c(Na+)+ c(H+)= c(OH-)+c(CH3COO-)
B.c(NH4+)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:c(NH4HSO4) > c[(NH4)2SO4]> c(NH4Cl)
C.25℃时,pH=4,浓度均为0.1mol·L—1的CH3COOH、CH3COONa混合溶液:
c(CH3COO—)+c(OH—)>c(CH3COOH)+c(H+)
D.NH4HSO4溶液中滴加NaOH至溶液恰好呈中性: c(Na+)=c(SO42-) >c(NH4+) >c(OH-) =c(H+)
查看答案和解析>>
科目: 来源:2012-2013学年江苏省高三10月阶段练习化学试卷(解析版) 题型:填空题
(15分)活性ZnO在橡胶、塑料、涂料工业中有重要应用,一种由粗ZnO(含FeO、CuO)制备活性ZnO的流程如下(已知:碱式碳酸锌经焙烧可制得活性ZnO):
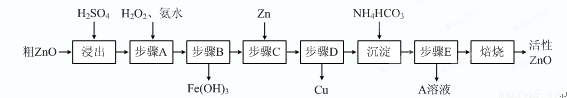
已知:几种离子生成氢氧化物沉淀时的pH如下表:
|
待沉淀离子 |
Fe2+ |
Fe3+ |
Zn2+ |
Cu2+ |
|
开始沉淀时pH |
6.34 |
1.48 |
6.2 |
5.2 |
|
完全沉淀时pH |
9.7 |
3.2 |
8.0 |
6.4 |
请问答下列问题:
⑴ 步骤A加H2O2发生反应的离子方程式是 ,该步骤需控制溶液pH的范围是 。
⑵ A溶液中主要含有的溶质是 。
⑶ 碱式碳酸锌经焙烧制得活性ZnO的反应△H>0,该反应能自发进行的原因是 。
⑷ 若经处理后的废水pH=8,此时Zn2+的浓度为 mg/L(常温下,Ksp[Zn(OH)2]=1.2×10-17)。
查看答案和解析>>
科目: 来源:2012-2013学年江苏省高三10月阶段练习化学试卷(解析版) 题型:填空题
(12分)下列框图涉及到的物质所含元素中,除一种元素外,其余均为1~18号元素。已知:A、F为无色气体单质,B为具有刺激性气味的气体,C为黑色氧化物,E为红色金属单质(部分反应的产物未列全)。

请回答下列问题:
(1)B的电子式为 。
(2)J、K是同种金属的氯化物,且K为白色沉淀。写出SO2还原J生成K的离子方程式 。
(3)汽车尾气中常含有D。B与D在加热和催化剂存在的条件下,发生反应生成两种对空气无污染的物质。请写出该反应的化学方程式 。
(4)有人认为:“表面化学”研究成果能使B和D的反应在催化剂表面进行时的效率大大提高,从而使污染物D的转化率大大提高。请你应用化学基本理论对此观点进行评价: 。
查看答案和解析>>
科目: 来源:2012-2013学年江苏省高三10月阶段练习化学试卷(解析版) 题型:填空题
(13分)由方铅矿(PbS)制备Pb和PbO2的方法如下:

PbO与焦炭煅烧时可能会发生如下反应:
PbO(s)+C(s)=Pb(s)+CO(g) ΔH=+108.5 kJ·mol—1 ①
PbO(s)+CO(g)=Pb(s)+CO2(g) ΔH=-64 kJ·mol—1 ②
(1)已知Pb与O2反应的热化学方程式为:2Pb(s)+O2(g)=2PbO(s) ΔH=-438 kJ·mol—1
则C完全燃烧的热化学方程式为 。
(2)能提高反应②中PbO转化率的措施有 (填字母)。
a.升高温度 b.增大压强 c.加入焦炭 d.加入催化剂
(3)制备过程中会产生SO2、NO、CO等有毒气体,可将它们按一定比例混合在一定条件下反应得到S、N2和CO2。若SO2与NO的体积比为1∶2,该反应的化学方程式为 。
(4)水溶液中铅的存在形态有多种,各形态的浓度分数α随溶液pH变化的关系如下图所示:
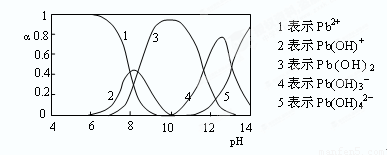
pH=6.5时,Pb2+水解的离子方程式为 ;加入NaClO制备PbO2之前需先用NaOH调节溶液pH至12.5,理由是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com