
科目: 来源:2013届海南省高二1班下学期期末考试化学试卷(解析版) 题型:填空题
(8分)已知:室温时,Ksp(AgCl)= 1.8×10-10mol2·L-2。请回答:
(1)饱和AgCl溶液的浓度是 mol/L。
(2)将2.0×10-5mol·L-1的AgNO3溶液与2.0×10-5mol·L-1的NaCl溶液等体积混合则混合后C(Ag+)= ,Qc= , 因为Qc Ksp(填“>”或“<”),所以 (填“有”或“无”)AgCl沉淀析出。
查看答案和解析>>
科目: 来源:2013届海南省高二1班下学期期末考试化学试卷(解析版) 题型:推断题
(10分)下图中A~I分别代表有关反应中的一种物质,其中A为酸式盐,请回答下列问题:
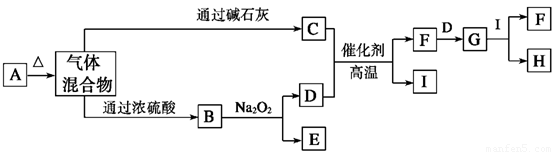 (1)A、F的化学式分别为
、 。?
(1)A、F的化学式分别为
、 。?
(2)I的电子式为 ;I的沸点较高的原因是
(3)E的水溶液中,各离子浓度由大到小的顺序为
。
(4)写出反应B+Na2O2 → D+E的化学方程式:
(5)指出实验室中保存H的方法及其原因:
查看答案和解析>>
科目: 来源:2013届海南省高二1班下学期期末考试化学试卷(解析版) 题型:填空题
(12分)常温下,ZnS的溶度积常数Ksp=1.20×10-23 ,H2S的电离常数K1=1.32×10-7 K2=7.10×10-15 回答下列问题:
(1)K1>>K2的原因是
(2)0.1 mol/L H2S溶液中氢离子的物质的量浓度是 (填字母)
A、等于0.1mol/L B、等于0.2mol/L
C、小于0.1mol/L D、在0.1~0.2mol/L之间
(3)0.1mol/LNa2S 溶液能使pH试纸变蓝,表明该现象的离子方程式是
(4)已知0.1mol/LNaHS溶液的pH约为9,则0.1mol/LNaHS溶液中各离子浓度由大到小的顺序是 。该溶液中的质子守恒关系式为
。
(5)向0.01mol/L的ZnCl2溶液中通入H2S(g)至饱和(c(H2S)按0.1mol/L计),为保证不产生ZnS沉淀,应控制c(H+)不低于 mol/L(已知7.811/2 =2.8)
查看答案和解析>>
科目: 来源:2013届海南省高二1班下学期期末考试化学试卷(解析版) 题型:填空题
12分)已知A(g)+B(g)  C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
|
|温度/ ℃ |
700 |
900 |
830 |
1000 |
1200 |
|
平衡常数 |
1.7 |
1.1 |
1.0 |
0.6 |
0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K= ,△H 0(填“<”“ >”“ =”);
(2)830℃时,向一个5 L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003 mol·L-1·s-1。,则6s时c(A)=
mol·L-1, C的物质的量为 mol;若反应经一段时间后,达到平衡时A的转化率为 ,如果这时将该密闭容器体积扩大1倍,则反应速率的变化是 ;
(3)判断该反应是否达到平衡的依据为 (填正确选项前的字母):
a.压强不随时间改变
b.气体的密度不随时间改变
c. c(A)不随时问改变
d.单位时间里生成c和D的物质的量相等
(4)1200℃时反应C(g)+D(g) A(g)+B(g)的平衡常数值是
。若
A(g)+B(g)的平衡常数值是
。若
此时给反应体系升温,(其他条件不变)则该平衡常数将 _____________ 。(填增大 或减小或不变)
查看答案和解析>>
科目: 来源:2013届海南省高二下学期期末理科化学试卷(解析版) 题型:选择题
下列原子或离子原子核外电子排布不属于基态排布的是
A. Na: 1s22s22p53s2 B. S2-: 1s22s22p63s23p6
C. N: 1s22s22p3 D. Si: 1s22s22p63s23p2
查看答案和解析>>
科目: 来源:2013届海南省高二下学期期末理科化学试卷(解析版) 题型:选择题
气态中性基态原子的原子核外电子排布发生如下变化,吸收能量最多的是
A. 1s22s22p63s23p3→1s22s22p63s23p2
B. 1s22s22p63s23p2→1s22s22p63s23p1
C. 1s22s22p63s23p4→1s22s22p63s23p3
D. 1s22s22p63s23p64s24p2→1s22s22p63s23p64s24p1
查看答案和解析>>
科目: 来源:2013届海南省高二下学期期末理科化学试卷(解析版) 题型:选择题
以下各微粒中,所有原子都满足最外层为8电子结构的是 ( )
A.H3O+ B.BF3 C.PCl5 D.CCl4
查看答案和解析>>
科目: 来源:2013届海南省高二下学期期末理科化学试卷(解析版) 题型:选择题
氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为
A.两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化, CH4是sp3型杂化
B.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强。
C.NH3分子中N原子形成3个杂化轨道,CH4分子中C原子形成4个杂化轨道。
D.氨气分子是极性分子而甲烷是非极性分子。
查看答案和解析>>
科目: 来源:2013届海南省高二下学期期末理科化学试卷(解析版) 题型:选择题
下列现象与氢键有关的是:
①NH3的熔、沸点比VA族其它元素氢化物的高
②小分子的醇、羧酸可以和水以任意比互溶
③冰的密度比液态水的密度小
④尿素的熔、沸点比醋酸的高
⑤邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低
⑥水分子高温下也很稳定
A.①②③④⑤⑥ B.①②③④⑤ C.①②③④ D.①②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com