
科目: 来源:2012-2013学年新课标高三配套月考(一)化学试卷(A卷)(解析版) 题型:选择题
[2012·九江一模]将一定质量的镁、铜合金加入到稀硝酸溶液中,两者恰好完全反应,假设反应过程中还原产物全部是NO,向所得溶液中加入物质的量浓度为3 mol·L-1的NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列有关叙述中正确的是 ( )
A.开始加入合金的质量可能为16.4g
B.参加反应的硝酸的物质的量为0.1mol
C.生成沉淀完全时消耗NaOH溶液的体积为100mL
D.标况下产物NO的体积为22.4 L
查看答案和解析>>
科目: 来源:2012-2013学年新课标高三配套月考(一)化学试卷(A卷)(解析版) 题型:推断题
[2012·西安交大附中一模](8分)A、B、C、D、E五种可溶性化合物,分别由阳离子Fe3+、Ba2+、Al3+、Na+、Ag+和阴离子NO3-、OH-、SO42-、Cl-、CO32-中的各一种组成(离子不重复)。现做如下实验:
①A和E的溶液显碱性,0.1mol·L-1A溶液的pH小于13;
②在B的溶液中逐滴加入氨水有白色沉淀生成,继续加氨水至过量,沉淀消失;
③在C的溶液中加入铁粉,溶液的质量增加;
④在D的溶液中加入过量的Ba(OH)2溶液,没有沉淀。
请回答下列问题:
(1)根据以上事实推断A—E的化学式:
A ;B ;C ;D ;E 。
(2)请用离子方程式表示A溶液显碱性的原因 。
(3)写出③、④的离子方程式:③ ;④ 。
查看答案和解析>>
科目: 来源:2012-2013学年新课标高三配套月考(一)化学试卷(A卷)(解析版) 题型:实验题
[2012·杭州一模](10分)化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求。某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol/L的KBr溶液、KI(含淀粉) 溶液、NaOH(含酚酞)溶液、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如下图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好。(已知:2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O)
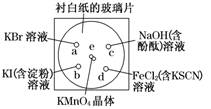
(1)e处反应的离子方程式为_____________________,该反应中发生反应的氧化剂和还原剂的物质的量之比为 。
(2)b处的实验现象为________________,d处的实验现象为___________________。
(3)c处反应的化学方程式为_____________________________,标准状况下,当有0.224 L Cl2被NaOH溶液吸收后,转移电子的物质的量为 mol。
(4)通过该实验能否比较Cl2、FeCl3、KMnO4三种物质氧化性的强弱? (填“能”或“不能”),若能,其氧化性由强到弱的顺序是 。
查看答案和解析>>
科目: 来源:2012-2013学年新课标高三配套月考(一)化学试卷(A卷)(解析版) 题型:推断题
[2012·临沂一模](10分)下列转化关系所涉及的物质都是中学化学常见物质。已知A、B为氧化物,C为固体单质,D为黄绿色气体。

请回答:
(1)指出A中存在的化学键类型: 。
(2)写出M与过量氨水反应的离子方程式: 。
(3)向溶液N中先通入过量二氧化碳,再加入过量稀盐酸。观察到的现象是
_____________ ________。
(4)电解熔融氧化物A,阳极的电极反应方程式为 。
(5)B与浓酸X反应的化学方程式为 。
(6)能不能直接蒸发溶液M得到M晶体? (填“能”或“不能”)。若能,不用回答;若不能,回答该如何操作? 。
查看答案和解析>>
科目: 来源:2012-2013学年新课标高三配套月考(一)化学试卷(A卷)(解析版) 题型:实验题
[2012·北京石景山一模](10分)我国制碱工业的先驱 侯德榜先生,1939年发明了著名的侯氏制碱法,其核心反应原理可用如下化学方程式表示:
侯德榜先生,1939年发明了著名的侯氏制碱法,其核心反应原理可用如下化学方程式表示:
NH3+CO2+NaCl+H2O=NH4Cl+NaHCO3(晶体)
依据此原理,欲制得碳酸氢钠晶体,某校学生设计了如下实验装置,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和。
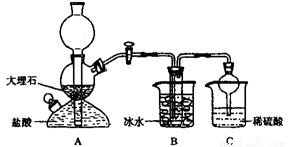
(1)A装置中所发生反应的离子方程式为 。
C装置中稀硫酸的作用为 。
(2)下表中所列出的是相关物质在不同温度下的溶解度数据(g/100g水)
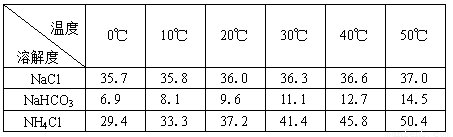
参照表中数据,请分析B装置中使用冰水的目的是 。
(3)该校学生在检查完此套装置气密性后进行实验,结果没有得到碳酸氢钠晶体,指导教师指出应在 装置之间(填写字母)连接一个盛有 的洗气装置,其作用是 。
(4)若该校学生进行实验时,所用饱和食盐水中含NaCl的质量为5.85g,实验后得到干燥的NaHCO3晶体的质量为5.04g,则NaHCO3的产率为 。
查看答案和解析>>
科目: 来源:2012-2013学年新课标高三配套月考(一)化学试卷(A卷)(解析版) 题型:实验题
[2012·南通二调](12分)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
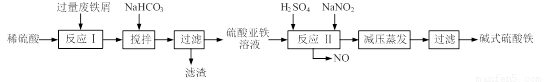 已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
|
沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
|
开始沉淀 |
2.3 |
7.5 |
3.4 |
|
完全沉淀 |
3.2 |
9.7 |
4.4 |
回答下列问题:
(1)加入少量NaHCO3的目的是调节pH,使溶液中的 沉淀,该工艺中“搅拌”的作用是 。
(2)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作 。若参与反应的O2有11.2L(标准状况),则相当于节约NaNO2的物质的量为 。
(3)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成Fe2(OH)42+聚合离子。该水解反应的离子方程式为 。
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为 。
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
查看答案和解析>>
科目: 来源:2012-2013学年新课标高三配套月考(一)化学试卷(A卷)(解析版) 题型:填空题
[2012·课标全国卷] (14分)铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)要确定铁的某氯化物为FeClx的化学式,可用离子交换和滴定的方法。实验中称取0.54 g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40 mol·L-1的盐酸滴定,滴至终点时消耗盐酸25.0 mL。计算该样品中氯的物质的量,并求出FeClx中x值:________________(列出计算过程);
(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe)∶n(Cl)=1∶2.1,则该样品中FeCl3的物质的量分数为________。在实验中,FeCl2可用铁粉和________反应制备,FeCl3可用铁粉和________反应制备;
(3)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为__________________;
(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为
______________________________;与MnO2—Zn电池类似,K2FeO4—Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为________________________,该电池总反应的离子方程式为_____________________________________。
查看答案和解析>>
科目: 来源:2012-2013学年新课标高三配套月考(一)化学试卷(B卷)(解析版) 题型:选择题
[2012·石家庄一模]下列判断合理的是( )
①硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
②蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质
③根据电解质在熔融状态下能否完全电离将电解质分为强电解质和弱电解质
④根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液
⑤根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应
⑥根据元素原子最外层电子数的多少将元素分为金属和非金属
A.只有②⑥ B.只有②⑤ C.只有①②⑤⑥ D.只有②③④⑤
查看答案和解析>>
科目: 来源:2012-2013学年新课标高三配套月考(一)化学试卷(B卷)(解析版) 题型:选择题
[2012·临沂一模]下列说法正确的是( )
A.7.1g氯气与足量的氢氧化钠溶液反应转移的电子数为0.2×6.02×1023
B.标准状况下,22.4LNO和11.2L O2混合后气体的分子总数为1.0×6.02×1023
C.工业用电解法进行粗铜精炼时,每转移1mol电子,阳极上溶解的铜原子数必为0.5×6.02×1023
D.VLamol·L-1的氯化铁溶液中,若Fe3+的数目为6.02×1023,则Cl-的数目大于3×6.02×1023
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com