
科目: 来源:2011-2012学年三校上海市)高三联考化学试卷(解析版) 题型:填空题
(本题共8分)
水煤气法制甲醇工艺流程框图如下

(注:除去水蒸气后的水煤气含55~59%的H2,15~18%的CO,11~13%的CO2,少量的H2S、CH4,除去H2S后,可采用催化或非催化转化技术,将CH4转化成CO,得到CO、CO2和H2的混合气体,是理想的合成甲醇原料气,即可进行甲醇合成)
(1)制水煤气的主要化学反应方程式为:C(s)+H2O(g) CO(g)+H2(g),此反应是吸热反应。① 此反应的化学平衡常数表达式为
;
CO(g)+H2(g),此反应是吸热反应。① 此反应的化学平衡常数表达式为
;
②下列能提高碳的平衡转化率的措施是 。
A.加入C(s) B.加入H2O(g) C.升高温度 D.增大压强
(2)将CH4转化成CO,工业上常采用催化转化技术,其反应原理为:
CH4
(g)+3/2O2 (g) CO (g)+2H2O (g) +519KJ。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同)
CO (g)+2H2O (g) +519KJ。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同)
① X在T1℃时催化效率最高,能使正反应速率加快约3×105倍;
② Y在T2℃时催化效率最高,能使正反应速率加快约3×105倍;
③ Z在T3℃时催化效率最高,能使逆反应速率加快约1×106倍;
已知:T1>T2>T3,根据上述信息,你认为在生产中应该选择的适宜催化剂是 (填“X”或“Y”或“Z”),选择的理由是 。
(3)合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,进行甲醇合成,主要反应是:2H2(g) + CO(g)  CH3OH(g)+181.6kJ。T4℃下此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
CH3OH(g)+181.6kJ。T4℃下此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
|
物质 |
H2 |
CO |
CH3OH |
|
浓度/(mol·L-1) |
0.2 |
0.1 |
0.4 |
① 比较此时正、逆反应速率的大小:v正 v逆 (填“>”、“<”或“=”)。
② 若加入同样多的CO、H2,在T5℃反应,10 min后达到平衡,此时c(H2)=0.4 mol·L-1、c(CO)=0.7 mol·L-1、则该时间内反应速率v(CH3OH) = mol·(L·min)-1。
(4)生产过程中,合成气要进行循环,其目的是 。
查看答案和解析>>
科目: 来源:2011-2012学年三校上海市)高三联考化学试卷(解析版) 题型:实验题
(本题共12分)
某化学课外小组设计了如下图所示的装置进行实验。图中箭头表示气体流向。A表示一种纯净、干燥的气体,B是另一种气体,反应进行一段时间后,装置己中有红棕色气体生成。实验中所用的药品和干燥剂只能从下列物质中选取:Na2CO3、NaHCO3、MnO2、Na2O2、NaCl、无水CaCl2 、NH4HCO3、碱石灰等固体和蒸馏水。
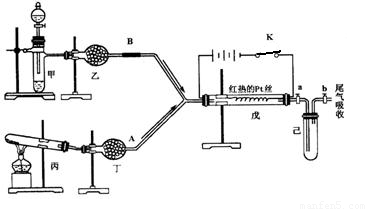
根据图中装置和反应现象请回答:
(1)丙中发生反应的化学方程式为 。
(2)丁中的干燥剂应选 ________,不选另一种干燥剂的由 。
(3)甲中发生反应的化学方程式为 。
(4)戊中发生的主要反应的化学方程式为____________________,此反应是________(吸热、放热)反应,能证明你的判断的现象是 。
(5)当己中充满红棕色气体后,停止给丙加热,并关闭a、b两个活塞,若将己浸入冰水中,则已中会出现的现象是:______________,产生此现象的原因: 。
查看答案和解析>>
科目: 来源:2011-2012学年三校上海市)高三联考化学试卷(解析版) 题型:实验题
(本题共12分)
下图是某化学兴趣小组进行丁烷裂解的实验流程。(注:CuO能将烃氧化成CO2和H2O,G后面装置与答题无关,省略铁架台等。)按下图连好装置后,需进行的实验操作有:①给D、G装置加热;②检查整套装置的气密性;③排出装置中的空气等……
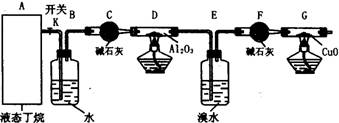
(1)这三步操作的先后顺序依次是 (写编号);
(2)简要说明排空气的方法和证明空气已排尽的方法 ;
(3)B装置所起的作用是 ;
(4)假定丁烷按C4H10→C2H6+C2H4和C4H10→CH4+C3H6的方式完全裂解,当(E+F)装置的总质量比反应前增加了0.7g,G装置的质量减少了1.76g,则丁烷的裂解产物中,甲烷与乙烷的物质的量之比为 。(假定流经D、G装置中的气体能完全反应)
若对E装置中的混合物再按以下流程实验:
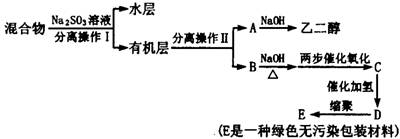
(5)分离操作Ⅰ和Ⅱ的名称分别是:Ⅰ Ⅱ ,Na2SO3溶液的作用是(用离子方程式表示) 。
(6)D的结构简式是 。
查看答案和解析>>
科目: 来源:2011-2012学年三校上海市)高三联考化学试卷(解析版) 题型:填空题
(本题共8分)
某有机物A能与NaOH溶液反应,其分子中含有苯环,相对分子质量小于150,其中含碳的质量分数为70.6%,氢的质量分数为5.9%,其余为氧。
(1)A的分子式是 。
(2)若A能与NaHCO3溶液反应放出CO2气体,其结构可能有 种。
(3)若A与NaOH溶液在加热时才能较快反应,且1molA消耗1mol NaOH,则A的所有可能的结构简式是 。
(4)若A与NaOH溶液在加热时才能较快反应,且1mol A消耗2mol NaOH,则符合条件的A的结构可能有 种,其中不能发生银镜反应的物质的结构简式是: 。
查看答案和解析>>
科目: 来源:2011-2012学年三校上海市)高三联考化学试卷(解析版) 题型:填空题
(本题共12分)
化合物A是石油化工的一种重要原料,用A和水煤气为原料经下列途径合成化合物D(分子式为C3H6O3)。
已知:

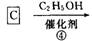


请回答下列问题;
(1)写出有关物质的结构简式:A: ;B: ;C: ;D: 。
(2)指出反应⑤的反应类型 。
(3)写出反应③的化学方程式 。
(4)反应④的目的是 。
化合物D’是D的一种同分异构体,它最早发现于酸牛奶中,是人体内糖类代谢的中间产物。D’在浓硫酸存在的条件下加热,既可生成能使溴水褪色的化合物E(C3H4O2),又可生成六原子环状化合物F(C6H8O4)。
请分别写出D’生成E和F的化学方程式:
(5)D’→E:
(6)D’→F:
查看答案和解析>>
科目: 来源:2011-2012学年三校上海市)高三联考化学试卷(解析版) 题型:计算题
(本题共6分)
某学生课外兴趣小组为了测定镁铝合金中铝的含量,进行了如下实验。将合金3.0克投入到足量的100 mL 1.5 mol•L-1的烧碱溶液中,充分反应后分离出未反应的镁,然后在溶液中滴加1.0 mol•L-1的盐酸,加入盐酸的体积与得到沉淀的数据如下表:
|
实验次数 |
加入盐酸的体积 |
沉淀质量 |
|
1 |
60 mL |
0 |
|
2 |
80 mL |
0.78 g |
|
3 |
180 mL |
5.46 g |
(1)开始沉淀时加入的盐酸体积必须大于 mL;若得到沉淀的量最大时,加入的盐酸体积为 mL。
(2)合金中铝的质量分数为 。
查看答案和解析>>
科目: 来源:2011-2012学年三校上海市)高三联考化学试卷(解析版) 题型:计算题
(本题共10分)
硫化钠是用于皮革鞣制的重要化学试剂,可用无水芒硝(Na2SO4)与炭粉在高温下反应而制得,反应式如下: Na2SO4+
4C Na2S+4CO↑ ② Na2SO4+4CO
Na2S+4CO↑ ② Na2SO4+4CO Na2S+4CO2
Na2S+4CO2
(1)现要制取Na2S 7.80 g,若生产过程中无水芒硝(Na2SO4)的利用率为90%,则理论上需要无水芒硝(Na2SO4) g(精确到0.01);
(2)若在反应中生成的Na2S物质的量为1 mol, 则消耗的碳单质的物质的量n的范围是
≤ n ≤ ;
(3)若在上述反应中消耗的碳单质为1 mol,生成Na2S的物质的量为 y mol,生成的CO和CO2的物质的量之比为x,则y与x的关系式为y= ;
(4)Na2S放置在空气中,会被缓慢氧化成Na2SO3及Na2SO4,现称取已经部分氧化的硫化钠样品39.20 g溶于水中,加入足量盐酸,充分反应后过滤得沉淀9.6 g,放出H2S气体1.12 L(标准状况)。请计算:39.20 g样品中各氧化产物的物质的量(不考虑气体在水中的溶解)。
查看答案和解析>>
科目: 来源:2011-2012学年浙江省高三化学冲刺综合测试化学试卷(解析版) 题型:选择题
化学与生产、生活、社会密切相关,下列说法正确的是
A.煤经气化和液化两个物理过程后可变为清洁能源,这是煤综合利用的主要方法
B.蛋白质、淀粉、纤维素、葡萄糖、油脂等都能在人体内水解并提供能量
C.利用风能发电、使用太阳能热水器、应用无氟制冷剂、无磷洗衣粉均有利于降低大气中的二氧化碳
D.钢筋混凝土、玻璃钢、石棉瓦、碳纤维增强陶瓷都是常见的复合材料
查看答案和解析>>
科目: 来源:2011-2012学年浙江省高三化学冲刺综合测试化学试卷(解析版) 题型:选择题
下列有关实验的说法正确的是
A.用标准NaOH溶液测定食醋中的总酸含量,若用酚酞为指示剂,则测定结果偏高。
B.结晶时,若溶质的溶解度越大,或溶液的浓度越高、或溶剂的蒸发速度越快,析出的晶粒就越细小
C.利用硝酸银和工业盐溶液可以检验火柴头中是否含有氯元素
D.制备阿司匹林时可能混有少量的聚合物杂质,可用碳酸氢钠溶液进行提纯
查看答案和解析>>
科目: 来源:2011-2012学年浙江省高三化学冲刺综合测试化学试卷(解析版) 题型:选择题
四种短周期元素W、X、Y、Z,其原子的最外层电子数之和为19,W和X元素原子核的质子数之比为1∶2, Y的核外电子数比X多4,Z的核电荷数大于X。下列说法正确的是
A.原子半径大小:Z>Y>X>W
B.由W元素形成的单质一定是原子晶体,其熔沸点很高
C.W、Y、Z三种元素形成的气态氢化物中最稳定的是Z的气态氢化物
D.Y、Z所形成的氧化物的水化物的酸性为:Y<Z
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com