
科目: 来源:2013届辽宁省分校高二下学期期末考试化学试卷(解析版) 题型:选择题
在相同条件下,总质量为2 g的CO和H2的混合气体,在O2中完全燃烧后全部通过足量的Na2O2固体,则固体质量增加( )
A、2 g B、1 g C、18 g D、无法计算
查看答案和解析>>
科目: 来源:2013届辽宁省分校高二下学期期末考试化学试卷(解析版) 题型:选择题
在标准状况下,进行甲、乙、丙三组实验:三组各取60 mL同浓度盐酸,加入同一种镁铝合金粉末,产生气体,有关数据列表如下:
|
实验序号 |
甲 |
乙 |
丙 |
|
合金质量/mg |
510 |
770 |
918 |
|
气体体积/mL |
560 |
672 |
672 |
则下列说法正确的是( )
A、甲组和乙组的实验中,盐酸均是过量的
B、盐酸的物质的量浓度为0.8 mol/L
C、合金中镁铝的物质的量之比为1∶1
D、 丙组中铝的物质的量为0.009 mol
查看答案和解析>>
科目: 来源:2013届辽宁省分校高二下学期期末考试化学试卷(解析版) 题型:选择题
现有AlCl3和MgSO4的混合溶液,向其中不断加入 NaOH溶液得到的沉淀的量与加入NaOH溶液的体积的关系如图所示,则原溶液中Cl-、SO42-的物质的量之比为( )

A、1∶1 B、2∶3 C、3∶2 D、6∶1
查看答案和解析>>
科目: 来源:2013届辽宁省分校高二下学期期末考试化学试卷(解析版) 题型:选择题
下列类比关系正确的是( )
A、AlCl3与过量NaOH溶液反应生成AlO2-,则与过量NH3·H2O反应也生成AlO2-
B、Na2O2与CO2反应生成Na2CO3和O2,则与SO2反应可生成Na2SO3和O2
C、Fe与Cl2反应生成FeCl3,则与I2反应可生成FeI3
D、Al与Fe2O3能发生铝热反应,则与MnO2也能发生铝热反应
查看答案和解析>>
科目: 来源:2013届辽宁省分校高二下学期期末考试化学试卷(解析版) 题型:选择题
在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如图所示,由此确定,原溶液中含有的阳离子是( )
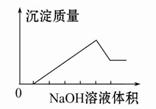
A、Mg2+、Al3+、Fe2+ B、H+、Mg2+、Al3+
C、H+、Ba2+、Al3+ D、只有Mg2+、Al3+
查看答案和解析>>
科目: 来源:2013届辽宁省分校高二下学期期末考试化学试卷(解析版) 题型:选择题
下列各项操作中,不发生“先产生沉淀,然后沉淀又溶解”现象的是( )
①向饱和碳酸钠溶液中通入过量的CO2;
②向NaAlO2溶液中逐滴加入过量的稀盐酸;
③向AlCl3溶液中逐滴加入过量稀氢氧化钠溶液;
④向硅酸钠溶液中逐滴加入过量的盐酸
A、①② B、①③ C、①④ D、②③
查看答案和解析>>
科目: 来源:2013届辽宁省分校高二下学期期末考试化学试卷(解析版) 题型:判断题
判断对错(每题1分,共5分)
1)冶炼铝时常用焦炭做还原剂。( )
2)钠的性质活泼,在空气中易发生反应,故应保存在CCl4或酒精中。 ( )
3)金属阳离子一定只具有氧化性。( )
4)碳酸氢钠在水溶液中的电离方程式为NaHCO3====Na++H++CO32-。( )
5)冰醋酸、冰水混合物、水玻璃、钢、淀粉都属于混合物 ( )
查看答案和解析>>
科目: 来源:2013届辽宁省分校高二下学期期末考试化学试卷(解析版) 题型:填空题
(共10分)写出符合要求的离子方程式
1)向FeBr2溶液中通入少量Cl2___________________________________________
2)向NaAlO2-溶液中通入足量CO2________________________________________
3)Ba(OH)2溶液中加入足量NaHCO3____________________________________
4)Na2O2投入FeCl2溶液中_______________________________________________
5)NaHCO3溶液中有少量Na2CO3的除杂反应_______________________________
查看答案和解析>>
科目: 来源:2013届辽宁省分校高二下学期期末考试化学试卷(解析版) 题型:填空题
(10分)CuI是难溶于水的白色固体。已知:氧化性Cu2+>I2>Cu+,还原性Cu>I->Cu+,氧化还原反应进行的方向是:较强氧化剂+较强还原剂→较弱还原产物+较弱氧化产物。
(1)根据物质氧化性、还原性的强弱推测,在溶液中Cu2+和I-反应的产物是________、________。
(2)久置于空气中的HI溶液呈黄色,向其中加入一些铜粉,可使溶液黄色消失,反应的化学方程式为___________________________________________________________
(3)欲消除(2)中HI溶液的黄色,也可向其中通入少量H2S,这是因为当浓度接近时,还原性H2S________(填“>”、“<”、“=”)I-;与加入铜粉的方法相比,用此方法得到的HI溶液浓度________(填“高”、“低”或“相等”)。
(4)CuI可用于监测空气中是否含有汞蒸气:4CuI(白色)+Hg===Cu2HgI4(亮黄色)+2Cu。下列关于该化学方程式的说法错误的是________。
a.该反应被氧化的元素是铜元素和汞元素
b.该反应的氧化剂为CuI
c.Cu2HgI4既是氧化产物又是还原产物
d.反应中转移电子 2 mol
查看答案和解析>>
科目: 来源:2013届辽宁省分校高二下学期期末考试化学试卷(解析版) 题型:实验题
(15分)某课外小组对一些金属单质和化合物的性质进行研究。
(1)下表为“铝与氯化铜溶液反应”实验报告的一部分:
|
实验步骤 |
实验现象 |
|
将打磨过的铝片过量放入一定浓度的CuCl2溶液中 |
产生气泡,析出疏松的红色固体,溶液逐渐变为无色 |
|
反应结束后分离出溶液备用 |
|
|
红色固体用蒸馏水洗涤后,置于潮湿空气中 |
一段时间后固体由红色变为绿色[视其主要成分为 |
|
Cu2OH2CO3 |
|
按反应类型写出实验中发生反应的化学方程式各一个是离子反应的只写离子方程式
置换反应____________,
化合反应____________。
(2)用石墨作电极,电解上述实验分离出的溶液,两极产生气泡。持续电解,在阴极附近的溶液中还可观察到的现象是______________________________________________。
解释此现象的离子方程式是_______________。
(3)工业上可用铝与软锰矿主要成分为MnO2反应来冶炼金属锰。
① 用铝与软锰矿冶炼锰的原理是用化学方程式表示_____________________________。
② MnO2在H2O2分解反应中作催化剂。若将适量MnO2加入酸化后的H2O2溶液中,MnO2溶解产生Mn2+,该反应的离子方程式______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com